Iridium(IV)oxide
| Iridium(IV)oxide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
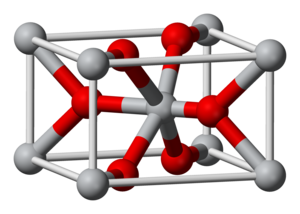
Kristalstructuur van iridium(IV)oxide
| ||||
| Algemeen | ||||
| Molecuulformule | IrO2 | |||
| IUPAC-naam | iridium(IV)oxide | |||
| Andere namen | iridiumdioxide | |||
| Molmassa | 224,2158 g/mol | |||
| SMILES | O=[Ir]=O
| |||
| InChI | 1S/Ir.2O
| |||
| CAS-nummer | 12030-49-8 | |||
| EG-nummer | 234-743-9 | |||
| PubChem | 82821 | |||
| Wikidata | Q418812 | |||
| Beschrijving | Zwart poeder | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | zwart | |||
| Dichtheid | 11,66 g/cm³ | |||
| Smeltpunt | 1100 °C | |||
| Onoplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | tetragonaal | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Iridium(IV)oxide is een oxide van iridium en heeft als brutoformule IrO2. De stof komt voor als een zwart poeder, dat onoplosbaar is in water.
Synthese
[bewerken | brontekst bewerken]Iridium(IV)oxide kan worden bereid door iridiumpoeder te verbranden:
Eigenschappen
[bewerken | brontekst bewerken]Onder invloed van hoge temperaturen vindt de ontledingsreactie plaats tot de samenstellende elementen. Wanneer het samen met zuurstofgas verhit wordt tot 1200°C, dan wordt iridium(VI)oxide gevormd, dat enkel maar in de gasfase en bij zeer hoge temperatuur stabiel is:
Kristalstructuur
[bewerken | brontekst bewerken]Iridium(IV)oxide heeft dezelfde kristalstructuur als titanium(IV)oxide (zogenaamde rutielstructuur). Het kristalliseert uit in een tetragonaal kristalstelsel en behoort tot ruimtegroep P42/mnm.[1] De parameters van de eenheidscel bedragen:
- a = 449,83 pm
- c = 354,4 pm
Toepassingen
[bewerken | brontekst bewerken]Het wordt enkel gebruikt om anode-elektroden te coaten voor industriële elektrolyse.
Externe link
[bewerken | brontekst bewerken]- ↑ (en) N.N. Greenwood & A. Earnshaw (1997) - Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann - ISBN 0080379419