Fibroblastgroeifactor


Fibroblastgroeifactoren (FGF) zijn een familie van celsignaleringseiwitten geproduceerd door macrofagen. Ze zijn betrokken bij een grote verscheidenheid aan processen, met name als onmisbare elementen voor de normale ontwikkeling van dierlijke cellen. Eventuele onregelmatigheden in hun functie leiden tot een reeks ontwikkelingsstoornissen. Deze groeifactoren werken doorgaans als systemische of lokaal circulerende moleculen van extracellulaire oorsprong die receptoren op het celoppervlak activeren. Een bepalende eigenschap van FGF's is dat ze binden aan heparine en aan heparinesulfaat. Sommige worden zo opgesloten in de extracellulaire matrix van weefsels die heparinesulfaatproteoglycaanen bevatten en worden lokaal vrijgegeven na verwonding of bij het omvormen van een weefsel.
FGF-moleculen binden zich aan hun specifieke receptoren (FGFR = FGF-receptor) op het celoppervlak. FGFR's zijn receptortyrosinekinasen die - na binding aan het ligand FGF - worden geactiveerd door autofosforylering en een intracellulaire signaalcascade initiëren met daaropvolgende genactivatie. FGFR's bestaan uit een extracellulair gebied dat drie immunoglobuline-achtige (IG-achtige) eiwitdomeinen (D1-D3), een enkele transmembraanhelix en een intracellulair eiwitdomein met tyrosinekinase-activiteit bevat. Een bijzonder kenmerk van het werkingsmechanisme van FGF's is dat het aanzienlijk wordt versterkt door de bijzonder hoge affiniteit van FGF's voor proteoglycanen, heparansulfaten en heparine (glycosaminoglycaan). Daarom werden de groeifactoren van de FGF-familie voorheen ook heparine-bindende groeifactoren (HBGF's) genoemd.
FGF's worden fysiologisch actief uitgescheiden bij alle vormen van weefselschade, maar vooral bij hypoxie en ischemie (upregulatie).
Families
[bewerken | brontekst bewerken]Bij de mensen zijn 23 leden van de FGF-familie geïdentificeerd, die allemaal ‘structureel’ verwante signaalmoleculen zijn:[1][2][3]
- De leden FGF1 tot en met FGF10 binden allemaal fibroblastgroeifactorreceptoren (FGFRs). FGF1 is ook bekend als zure fibroblastgroeifactor en FGF2 is ook bekend als basische fibroblastgroeifactor
- De leden FGF11, FGF12, FGF13 en FGF14 zijn ook bekend als FGF-homologe factoren 1-4 (FHF1-FHF4). Er is aangetoond dat ze verschillende functies hebben in vergelijking met de FGF's. Hoewel deze factoren opmerkelijk vergelijkbare sequentiehomologie bezitten, binden ze niet aan FGFR's en zijn ze betrokken bij intracellulaire processen die geen verband houden met de FGF's.[4] Deze groep is ook bekend als "iFGF".[5]
- Humaan FGF18 is betrokken bij de celontwikkeling en morfogenese in verschillende weefsels, waaronder kraakbeen.[6]
- Humaan FGF20 werd geïdentificeerd op basis van zijn homologie met Xenopus FGF-20(XFGF-20).[7][8]
- FGF15 tot en met FGF23 werden later beschreven en de functies worden nog steeds gekarakteriseerd. FGF15 is de muizenhomoloog van het humane FGF19 (er bestaat geen humaan FGF15) en waar hun functies worden gedeeld, worden ze vaak beschreven als FGF15/19.[9] In tegenstelling tot de lokale activiteit van de andere FGF's hebben FGF15/19, FGF21 en FGF23 hormonale systemische effecten.[9][10]
Alternatieve mRNA-splitsing geeft aanleiding tot 'b'- en 'c'-varianten van FGFR's 1, 2 en 3. Via dit mechanisme kunnen zeven verschillende signalerende FGFR-subtypen op het celoppervlak tot expressie worden gebracht. Elke FGFR bindt aan een specifieke subset van de FGF's. Op dezelfde manier kunnen de meeste FGF's binden aan verschillende FGFR-subtypen. FGF1 wordt ook wel het 'universele ligand' genoemd, omdat het in staat is alle zeven verschillende FGFR's te activeren. FGF7 (keratinocytgroeifactor, KGF) bindt daarentegen alleen aan FGFR2b (KGFR).
Aangenomen wordt dat het signaalcomplex op het celoppervlak een tertiair complex is, gevormd tussen twee identieke FGF-liganden, twee identieke FGFR-subeenheden en één of twee heparansulfaatketens.
Geschiedenis
[bewerken | brontekst bewerken]Een mitogene groeifactoractiviteit werd in 1973 door Armelin gevonden in hypofyse-extracten[11] en verder werk van Gospodarowicz, gepubliceerd in 1974, beschreef een meer gedefinieerde isolatie van eiwitten uit een extract van koeienhersenen die, wanneer getest in een bioassay die de proliferatie van fibroblasten veroorzaakte, bracht deze onderzoekers ertoe de naam "fibroblastgroeifactor" te gebruiken.[12] In 1975 fractioneerden ze het extract verder met behulp van een zure en basische pH en isoleerden ze twee enigszins verschillende vormen die "zure fibroblastgroeifactor" (FGF1) en "basische fibroblastgroeifactor" werden genoemd (FGF2). Deze eiwitten hadden een hoge mate van sequentiehomologie tussen hun aminozuurketens, maar er werd vastgesteld dat het verschillende eiwitten waren.
Niet lang nadat FGF1 en FGF2 waren geïsoleerd, isoleerde een andere groep onderzoekers een paar heparinebindende groeifactoren die zij HBGF-1 en HBGF-2 noemden, terwijl een derde groep een paar groeifactoren isoleerde die proliferatie van cellen veroorzaakten in een bioassay met endotheelcellen van bloedvaten, die ze ECGF1 en ECGF2 noemden. Uiteindelijk werd aangetoond dat deze onafhankelijk van elkaar ontdekte eiwitten dezelfde reeks moleculen waren, namelijk FGF1, HBGF-1 en ECGF-1 waren allemaal dezelfde zure fibroblastgroeifactor beschreven door Gospodarowicz, et al., terwijl FGF2, HBGF-2 en ECGF-2 allemaal dezelfde fundamentele fibroblastgroeifactor waren.[13]
Structuur
[bewerken | brontekst bewerken]De kristalstructuren van FGF1 zijn opgelost en blijken verband te houden met interleukine 1-bèta. Beide families hebben dezelfde bèta-klaverbladvouwing bestaande uit een 12-strengige bèta-sheet structuur, waarbij de bèta-sheets zijn gerangschikt in 3 soortgelijke lobben rond een centrale as, waarbij 6 strengen een anti-parallelle bèta-barrel vormen.[14][15][16] Over het algemeen zijn de bèta-sheets goed geconserveerd gebleven en liggen de kristalstructuren in deze gebieden over elkaar heen. De tussenliggende lussen zijn minder goed geconserveerd - de lus tussen bèta-sheetsstrengen 6 en 7 is iets langer in interleukine-1 bèta.
Functies en medische betekenis
[bewerken | brontekst bewerken]De verschillende FGF-typen hebben intense mitogene activiteiten en zijn van groot belang voor orgaandifferentiatie en -ontwikkeling in de embryonale periode. Ze reguleren celproliferatie, migratie en differentiatie. Reguliere cel- en weefseldifferentiatie is niet mogelijk zonder FGF’s. In volwassen weefsels en organen hebben FGF's - vooral FGF-1 - een extreem intensieve activiteit bij het induceren van angiogenese. Deze eigenschap van FGF's heeft onlangs de belangstelling gewekt van medisch onderzoek, omdat angiogenese kan worden gebruikt als een therapeutisch principe bij die ziekten en aandoeningen waarbij er sprake is van een stoornis van de arteriële bloedstroom (arteriosclerose), b.v. coronaire hartziekte (CHD) en perifere arteriële ziekte (PAD).[17] [18] [19] Hypoxie en ischemie veroorzaken de uitscheiding van FGF-1 en FGF-2, wat resulteert in een up-regulatie van FGF-receptoren in het weefsel. De inductie van angiogenese veroorzaakt door de binding van FGF en FGFR kan worden begrepen in de zin van een herstelproces dat de bloedcirculatie verbetert. Klinische onderzoeken met patiënten die lijden aan ernstige coronaire hartziekte hebben door FGF-1 geïnduceerde nieuwe bloedvaten in de menselijke hartspier aangetoond, evenals een lokale toename van de bloedstroom met een vermindering van de symptomen van angina pectoris.[20] [21] [22] Zelfs bij stoornissen bij de wondgenezing, b.v. bij diabeteszweren bevorderen FGF's, vooral FGF-1, de wondgenezing. Dierproeven hebben zelfs aangetoond dat FGF-1 de omvang van een beroerte aanzienlijk vermindert.
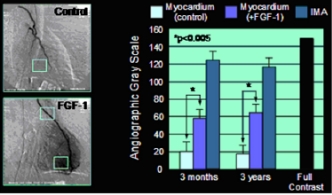 |
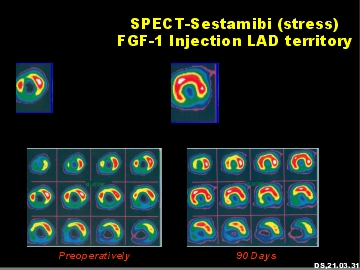 |
Vanwege de brede mitogene activiteit van FGF's worden ze in het huidige klinische onderzoek ook onderzocht op hun positieve effect op osteoporose (activering van osteoblasten door FGF-1) en op hun herstelpotentieel voor kraakbeenschade (artrose). FGF-1 en (in mindere mate) FGF-2 kunnen mogelijk ook zogenaamde cardiale voorlopercellen stimuleren in de zin van rijping van deze lokale, in het myocard aanwezige, hartspiervoorlopercellen tot volwassen hartspiercellen. Ten slotte ligt een ander klinisch potentieel van FGF-1 in zijn vermogen om zenuwcellen te regenereren.[23]
Omdat FGF's ook in verhoogde concentraties in veel tumoren voorkomen en betrokken zijn bij tumorangiogenese, is onderzoek naar anti-angiogene tumortherapie.[24] ook gericht op het remmen van de angiogene activiteit van FGF's.
- ↑ Head Trauma: Basic, Preclinical, and Clinical Directions. Wiley, New York (2001), "Growth factors", 165–187. ISBN 0-471-36015-5.
- ↑ Blaber M, DiSalvo J, Thomas KA (Feb 1996). X-ray crystal structure of human acidic fibroblast growth factor. Biochemistry 35 (7): 2086–94. PMID 8652550. DOI: 10.1021/bi9521755.
- ↑ Ornitz DM, Itoh N (2001). Fibroblast growth factors. Genome Biology 2 (3): reviews3005.1–reviews3005.12. PMID 11276432. PMC 138918. DOI: 10.1186/gb-2001-2-3-reviews3005.
- ↑ Olsen SK, Garbi M, Zampieri N, Eliseenkova AV, Ornitz DM, Goldfarb M, Mohammadi M (Sep 2003). Fibroblast growth factor (FGF) homologous factors share structural but not functional homology with FGFs. The Journal of Biological Chemistry 278 (36): 34226–36. PMID 12815063. DOI: 10.1074/jbc.M303183200.
- ↑ Itoh N, Ornitz DM (Jan 2008). Functional evolutionary history of the mouse Fgf gene family. Developmental Dynamics 237 (1): 18–27. PMID 18058912. DOI: 10.1002/dvdy.21388.
- ↑ Moore EE, Bendele AM, Thompson DL, Littau A, Waggie KS, Reardon B, Ellsworth JL (Jul 2005). Fibroblast growth factor-18 stimulates chondrogenesis and cartilage repair in a rat model of injury-induced osteoarthritis. Osteoarthritis and Cartilage 13 (7): 623–631. PMID 15896984. DOI: 10.1016/j.joca.2005.03.003.
- ↑ Koga C, Adati N, Nakata K, Mikoshiba K, Furuhata Y, Sato S, Tei H, Sakaki Y, Kurokawa T, Shiokawa K, Yokoyama KK (Aug 1999). Characterization of a novel member of the FGF family, XFGF-20, in Xenopus laevis. Biochemical and Biophysical Research Communications 261 (3): 756–65. PMID 10441498. DOI: 10.1006/bbrc.1999.1039.
- ↑ Kirikoshi H, Sagara N, Saitoh T, Tanaka K, Sekihara H, Shiokawa K, Katoh M (Aug 2000). Molecular cloning and characterization of human FGF-20 on chromosome 8p21.3-p22. Biochemical and Biophysical Research Communications 274 (2): 337–43. PMID 10913340. DOI: 10.1006/bbrc.2000.3142.
- ↑ a b Potthoff MJ, Kliewer SA, Mangelsdorf DJ (Feb 2012). Endocrine fibroblast growth factors 15/19 and 21: from feast to famine. Genes & Development 26 (4): 312–324. PMID 22302876. PMC 3289879. DOI: 10.1101/gad.184788.111.
- ↑ Fukumoto S (Mar 2008). Actions and mode of actions of FGF19 subfamily members. Endocrine Journal 55 (1): 23–31. PMID 17878606. DOI: 10.1507/endocrj.KR07E-002.
- ↑ Armelin HA (Sep 1973). Pituitary extracts and steroid hormones in the control of 3T3 cell growth. Proceedings of the National Academy of Sciences of the United States of America 70 (9): 2702–6. PMID 4354860. PMC 427087. DOI: 10.1073/pnas.70.9.2702.
- ↑ Gospodarowicz D (May 1974). Localisation of a fibroblast growth factor and its effect alone and with hydrocortisone on 3T3 cell growth. Nature 249 (453): 123–7. PMID 4364816. DOI: 10.1038/249123a0.
- ↑ Burgess WH, Maciag T (1989). The heparin-binding (fibroblast) growth factor family of proteins. Annu Rev Biochem 58: 575–606. PMID 2549857. DOI: 10.1146/annurev.bi.58.070189.003043.
- ↑ Murzin AG, Lesk AM, Chothia C (Jan 1992). beta-Trefoil fold. Patterns of structure and sequence in the Kunitz inhibitors interleukins-1 beta and 1 alpha and fibroblast growth factors. Journal of Molecular Biology 223 (2): 531–43. PMID 1738162. DOI: 10.1016/0022-2836(92)90668-A.
- ↑ Eriksson AE, Cousens LS, Weaver LH, Matthews BW (Apr 1991). Three-dimensional structure of human basic fibroblast growth factor. Proceedings of the National Academy of Sciences of the United States of America 88 (8): 3441–5. PMID 1707542. PMC 51463. DOI: 10.1073/pnas.88.8.3441.
- ↑ Gimenez-Gallego G, Rodkey J, Bennett C, Rios-Candelore M, DiSalvo J, Thomas K (Dec 1985). Brain-derived acidic fibroblast growth factor: complete amino acid sequence and homologies. Science 230 (4732): 1385–8. PMID 4071057. DOI: 10.1126/science.4071057.
- ↑ J. Folkman: Angiogenic therapy of the heart. In: Circulation 97, 1998, S. 628–629. PMID 9495294
- ↑ M. Simons u. a.: Clinical trials in coronary angiogenesis: issues, problems, consensus: an expert panel summary. In: Circulation 102, 2000, S. E73–E86. PMID 10982554
- ↑ R. Khurana und M. Simons: Insights from angiogenesis trials using fibroblast growth factor for advanced arteriosclerotic disease. In: Trends Cardiovasc Med 13, 2003, S. 116–122. PMID 12691676
- ↑ T. J. Stegmann, und T. Hoppert: Combined local angiogenesis and surgical revascularization for coronary heart disease. In: Current Intervent Cardiol Reports 1, 1999, S. 172–178. PMID 11096622
- ↑ T. J. Stegmann u. a.: Therapeutic angiogenesis: intramyocardial growth factor delivery of FGF-1 as sole therapy in patients with chronic coronary artery disease. (PDF; 449 kB) In: CVR 1, 2000, S. 259–267.
- ↑ L. E. Wagoner u. a.: Angiogenesis Protein Therapy With Human Fibroblast Growth Factor (FGF-1): Results Of A Phase I Open Label, Dose Escalation Study In Subjects With CAD Not Eligible For PCI Or CABG. In: Circulation 116, 2007, S. 443.
- ↑ J. M. A. Laird u. a.: Acidic Fibroblast growth factor stimulates motor and sensory axon regeneration after sciatic nerve crush in the rat. In: Neuroscience 65, 1995, S. 209–216. PMID 7538644
- ↑ J. Folkman: Fighting cancer by attacking its blood supply. In: Sci Am 275, 1996, S. 150–154. PMID 8701285