Borrelia
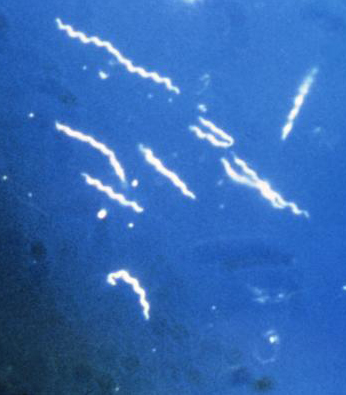
Il genere batterico Borrelia è costituito da microrganismi gram negativi a forma spirillare, che possono infettare esseri umani e animali (cervo, ratti, roditori, uccelli, che costituiscono i "serbatoi") causando malattie infettive note come borreliosi, che in genere vengono trasmesse dagli animali agli umani tramite insetti vettori, che più spesso sono zecche oppure pidocchi. La neuroborreliosi consiste nell'infezione acuta oppure cronica del sistema nervoso centrale da parte di spirochete del genere Borrelia, con possibile meningite, encefalite, vasculite e sintomi a lungo termine simili a quelli della sifilide o di alcune malattie autoimmuni come il LES e la sclerosi multipla.
| Borrelia | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Prokaryota |
| Regno | Bacteria |
| Phylum | Spirochaetes |
| Classe | Spirochaetes |
| Ordine | Spirochaetales |
| Famiglia | Spirochaetaceae |
| Genere | Borrelia Swellengrebel, 1907 |
Specie
modificaIl genere Borrelia possiede almeno 37 specie note; di queste, 12 sono correlate con la malattia di Lyme o con altre borreliosi. Esso possiede un buon numero, tuttora ignoto, di ceppi. Il nome spesso si riferisce alle varie specie di Borrelia che sono notori agenti della malattia di Lyme (e affini) con il termine Borrelia burgdorferi sensu lato, e da qualche tempo si è scoperto che possiedono una maggiore variabilità genetica rispetto a quel che si pensava in precedenza.[1]
Borrelia recurrentis
modificaCon l'eccezione della Borrelia recurrentis (che causa la febbre ricorrente da zecche e da pidocchi e che viene trasmessa anche dal pidocchio del corpo umano), si pensa che tutte le altre specie del genere Borrelia siano trasmesse esclusivamente dalle zecche.[2] La Borrelia recurrentis è un batterio gram negativo, a forma di grossa spirocheta. È l'agente infettivo della febbre ricorrente, che si manifesta nei climi freddi delle zone montuose del nord-ovest degli Stati Uniti. La diagnosi è molto più semplice rispetto a quella delle altre borreliosi (anche per questo venne scoperta 50 anni prima delle altre), perché durante le puntate febbrili l'agente infettivo può essere colorato con i metodi batterioscopici per il sangue come la colorazione di Giemsa o la colorazione di Wright. La borrelia recurrentis è l'unica citata nei vecchi testi (prima del 1970), per il fatto che è molto più facile da coltivare, si può isolare dal sangue e coltivare nella cavità allantoidea dell'embrione di pollo oppure in mezzi liquidi con acqua distillata e glucosio mescolata a siero, sangue o frammenti del tessuto del paziente che si sospetta infetto, e predilige le basse temperature. Nelle vecchie sacche di sangue infetto può sopravvivere per mesi a 4° Celsius.
Specie di Borrelia scoperte successivamente
modificaI vari ceppi di Borrelia scoperti successivamente (anni ottanta) sono molto più difficili da isolare. Si ottengono da punture del sangue del lobo dell'orecchio, del liquido sinoviale o del liquido cerebrospinale, e devono essere coltivate nel mezzo BSK (Barbour-Stoenner-Kelly: acqua doppiamente distillata, con glucosio, senza tracce di ferro, arricchito da siero e grasso di coniglio) riscaldato per settimane a 32 °C in ambiente microaerobico.[3] L'esame batterioscopico si fa sulla coltura così ottenuta, con il microscopio a campo oscuro. Lo screening di massa nella popolazione è stato reso possibile dalla ricerca degli anticorpi contro le proteine di superficie della Borrelia, tramite metodi immunoenzimatici come l'ELISA e il Western Blot, che spesso presentano difetti di sensibilità e specificità. Con i più moderni e sensibili metodi di scoperta e classificazione dei vari ceppi batterici di Borrelia si cercano minuscole quantità del DNA batterico delle varie specie di Borrelia, tramite la reazione a catena della polimerasi (PCR).
Borrelia burgdorferi, ceppi e specie affini
modificaLa Borrelia burgdorferi è l'agente eziologico della malattia di Lyme (dal nome dell'omonimo paesino), ovvero un'affezione multi-organica, divisa in tre stadi, che può colpire la pelle, il cuore, le articolazioni e l'encefalo oltre che i nervi periferici (neuroborreliosi), causata sia dall'invasione diretta di questi batteri gram negativi (spirochete del genere Borrelia) sia dalla violenta e sregolata reazione autoimmune in alcuni soggetti. Fino a poco tempo fa si pensava che vi fossero soltanto tre genospecie che causano la malattia di Lyme:
- Borrelia burgdorferi sensu stricto (predominante nel Nord America, ma anche in Europa),
- Borrelia afzelii (predominante in Eurasia)
- Borrelia garinii (predominante in Eurasia).
Al giorno d'oggi sono noti i genomi completi della B. burgdorferi sensu stricto (ceppo B31), della B. garinii (ceppo PBi) e della B. afzelii (ceppo PKo). Il ceppo genetico originale di B. burgdorferi (ceppo B31) venne ottenuto per clonazione limitata diluzionale dai germi isolati nell'organismo della zecca della malattia di Lyme, che è stata studiata per la prima volta dal microbiologo Alan Barbour.[4][5] Correntemente, i test diagnostici sono basati soltanto sui batteri B. burgdorferi sensu stricto (la unica specie che viene indagata negli USA), B. afzelii e B. garinii. Esiste una crescente e forte evidenza che molte specie diverse sono coinvolte in manifestazioni cliniche peculiari della malattia.[6][7]
Evoluzione di Borrelia burgdorferi
modificaCome molti altri batteri, Borrelia burgdorferi attua diversi meccanismi di trasferimento genico orizzontale (HGT, horizontal gene transfer), il quale consiste nel movimento di informazione genetica tra cellule della stessa generazione. Questi meccanismi sono per esempio la trasduzione e la coniugazione. Tutti assieme contribuiscono all'evoluzione dell'organismo e al suo processo di selezione naturale, tramite la rimozione di mutazioni deleterie e la raccolta di mutazioni benefiche in un singolo genoma. Da ciò ne consegue che la maggior parte degli individui della popolazione possiede gli stessi alleli, ovvero i più vantaggiosi per l'organismo. B. burgdorferi, però, attua un limitato HGT. Infatti, i suoi geni sono caratterizzati da polimorfismo. Il polimorfismo è la presenza di due o più alleli in un locus di una popolazione, ciascuno con frequenza apprezzabile. In altre parole, i suoi geni mostrano diversità allelica. Questa diversificazione è controllata dalla selezione stabilizzante.
La selezione stabilizzante è un processo nel quale i ricombinanti hanno un vantaggio selettivo. Esso produce diversificazione genetica in quanto alleli multipli sono mantenuti nel pool genico di una popolazione ad alta frequenza. Ciò può avvenire attraverso due diversi meccanismi: la selezione negativa frequenza-dipendente (negative frequency-dependent selection, NFDS) e i polimorfismi a nicchie multiple (multiple niche polymorphisms, MNP).
NFDS è un processo evolutivo attraverso il quale la fitness di un fenotipo diminuisce quando questo diventa sempre più comune. Ciò vuol dire che i genotipi più rari hanno un vantaggio selettivo rispetto ai genotipi comuni. OspC, che codifica per una proteina esterna di superficie, è il locus che mostra più diversificazione genetica in B. burgdorferi. In ospC, NFDS è prodotta dalla risposta immunitaria. Grazie alla memoria immunitaria, un animale precedentemente infettato da un ceppo di B. burgdorferi con uno specifico ospC non può essere reinfettato dallo stesso ceppo, in quanto l’animale possiede già gli anticorpi contro quel specifico serotipo. L’animale, però, potrà essere infettato da un ceppo con un diverso ospC, per il quale non possiede anticorpi.
MNP, invece, avviene quando l’ambiente è eterogeneo e nessun serotipo ha una fitness più alta rispetto ad altri in ciascun ambiente. Per ambienti si intendono le diverse specie di vertebrati che B. burgdorferi utilizza come ospiti. Possiamo immaginare ogni specie come una diversa nicchia ecologica. Più nicchie ci sono, maggiore sarà la diversificazione genetica in Borrelia. B. burgdorferi può infettare molti vertebrati, per esempio il topo, lo scoiattolo, il cervo e l’uomo. Essi sono molto diversi l’uno dall’altro e questo porta allo sviluppo di diversi serotipi ospC.
Evasione del sistema immunitario da parte di Borrelia burgdorferi
modificaUna delle ragioni per cui B. burgdorferi è considerato un patogeno pericoloso è la sua alta patogenicità dovuta alle diverse strategie che attua per evadere il sistema immunitario dell’ospite. Queste sono per esempio:
- L’utilizzo di Manganese negli enzimi respiratori. Molti batteri necessitano il ferro per produrre i loro enzimi. Una delle risposte immunitarie dell’ospite a un’infezione batterica connesse alla febbre è di limitare la concentrazione di ferro nel sangue. B. burgdorferi, però, aggira questo sistema usando il manganese al posto del ferro.
- Sostanze immunosopressive nella saliva della zecca. La saliva della zecca contiene una proteina che inattiva le cellule T del sistema immunitario.
- Uscita dal flusso sanguigno. B. burgdorferi può uscire dal flusso sanguigno, verso la zona sotto-cutanea, il liquido sinoviale e il liquido cerebro-spinale. Per evadere il sistema immunitario e per diffondersi in tutto l’organismo.
- Resistenza agli antibiotici. Nonostante i trattamenti con antibiotici, B. burgdorferi può reinfettare l’ospite perché va incontro a uno stato di crescita minima durante il trattamento (formando forme latenti "L" intracellulari). Quando le concentrazioni dell’antibiotico diminuiscono ricomincia a dividersi.
- Cambiamento della proteina esterna di superficie osp. Osp è una proteina antigenica che il sistema immunitario riconosce per poter produrre anticorpi. Borrelia, però, può cambiare l’espressione di questa proteina così che gli anticorpi precedentemente prodotti non sono più efficaci contro la nuova proteina.
Borrelia valaisiana
modificaLa Borrelia valaisiana venne identificata come una specie genomica dal "ceppo VS116", e venne battezzata Borrelia valaisiana nel 1997.[8] Successivamente è stata rilevata con la reazione a catena della polimerasi (PCR) nel liquido cerebrospinale (CSF) in Grecia,[9] ed è presente in tutta l'Eurasia; vi sono rapporti di isolamenti in Francia, Regno Unito, Italia, Germania, Paesi Bassi, Svizzera, Polonia, Spagna, Irlanda, Repubblica Ceca, Slovacchia, Russia e Turchia. B. valaisiana è stata coltivata anche in Corea, Taiwan, le parti meridionali e centrali della Cina, nell'isola di Okinawa, in Giappone[10][11].
Nuove genospecie mondiali: B. lusitaniae, B. bissettii, B. spielmanii
modificaNuove genospecie scoperte di recente, si sono dimostrate patogenetiche negli umani: Borrelia lusitaniae[12] in Europa (specialmente in Portogallo), nel Nord Africa e in Asia, Borrelia bissettii[13][14] negli USA e in Europa, e la Borrelia spielmanii[15][16] in Europa.
Borrelie asiatiche: B. japonica, B. tanukii, B. turdae, B. sinica
modificaUlteriori genospecie di B. burgdorferi sensu lato sospettate di essere causa di malattia, dato non confermato dalla cultura batteriologica, includono Borrelia japonica, Borrelia tanukii e Borrelia turdae (Giappone), Borrelia sinica (Cina) e Borrelia andersonii (USA). Alcune di queste specie sono trasportate da altri tipi di zecche, che la medicina corrente non riconosce come vettori della malattia di Lyme. La spirocheta Borrelia miyamotoi, correlata al gruppo di spirochete della febbre ricorrente, è sospettata di essere anche una causa di malattia in Giappone. Spirochete simili alla B. miyamotoi sono state scoperte recentemente sia nelle zecche Ixodes ricinus in Svezia sia nelle zecche Ixodes scapularis negli USA[17][18]
STARI: Borrelia lonestari
modificaOltre a questo gruppo di genospecie strettamente correlate, specie addizionali di Borrelia, degne di interesse, includono la Borrelia lonestari, una spirocheta recentemente scoperta nella zecca Lone Star tick (Amblyomma americanum) negli USA centro-meridionali (attorno al Texas)[19][20][21], riscontrata anche in Brasile[22]. Vi sono forti indizi che la B. lonestari sia la causa della STARI (Southern Tick-Associated Rash Illness), nota anche come malattia di Masters in onore del suo scopritore Ed Masters. La malattia si verifica in seguito al morso di una zecca Lone Star tick e clinicamente si assomiglia alla malattia di Lyme, anche se gli affetti da questa infezione presentano abitualmente dei test negativi per la malattia di Lyme.[23] Attualmente non esiste alcun test diagnostico per la malattia STARI/Masters, e non esiste alcun protocollo di trattamento ufficiale, anche se in genere si prescrivono somministrazioni degli antibiotici più potenti (ceftriaxone e doxiciclina), per periodi di molte settimane.
Caratteristiche genomiche
modificaUna delle caratteristiche più sorprendenti dell'intero genere di Borrelia burgdorferi quando viene confrontato con altri eubatteri è il suo davvero inusuale ed enorme genoma, che è molto più complesso rispetto a quello della sua cugina spirochetale Treponema pallidum, l'agente della sifilide, malattia nota sin dal tardo medioevo come "morbo gallico".[24] Il genoma di B. burgdorferi include un cromosoma lineare, di dimensioni approssimativamente di una megabase, con 21 plasmidi (12 lineari e 9 circolari) - di gran lunga il maggiore numero di plasmidi che si possa trovare in qualsiasi batterio noto.[25] Un forte tasso di scambi genetici, che include il trasferimento di plasmidi, contribuisce alla grande patogenicità potenziale nell'organismo umano e animale.[26] La cultura a lungo termine della B. burgdorferi provoca la perdita di alcuni plasmidi e cambiamenti nell'espressione dei profili proteici. Associata alla perdita dei plasmidi si verifica una perdita nell'abilità del microorganismo a infettare gli animali di laboratorio, facendo intuire che i plasmidi codifichino per geni chiave coinvolti nella virulenza. L'analisi chimica della membrana esterna della Borrelia burgdorferi rivela la presenza di un contenuto del 46% in proteine, 51% in lipidi e del 3% in carboidrati.[27]
Altre proteine di superficie
modificaLa membrana esterna della Borrelia burgdorferi è composta da vari tipi di lipoproteine (Osp) di superficie esterna che sono state accuratamente studiate e caratterizzare (Dalla Osp A fino alla OspF). Si presume che giochino un ruolo nella virulenza. Osp A e Osp B sono di gran lunga le più abbondanti proteine di superficie della Borrelia. I geni per la OspA e OspB codificano le principali proteine di superficie della B burgdorferi. Le due proteine Osp mostrano un alto grado di similitudine nella sequenza aminoacidica, indicando che sono un evento evolutivo recente. L'analisi molecolare e il confronto della sequenza della OspA e della OspB con quella di altre proteine ha rivelato somiglianze con il peptide segnale delle lipoproteine procariotiche.[28] Virtualmente tutte le spirochete nell'intestino medio di una zecca mai nutrita, allo stato di ninfa, esprimono la proteina Osp A. La OspC è una proteina che viene percepita come un antigene estraneo dall'organismo ospite e può stimolare la risposta immune. Ogni cellula batterica contiene soltanto una copia del gene che codifica per la OspC, ma le popolazioni di B. burgdorferi hanno mostrato grande variabilità tra individui nella sequenza genica per OspC.[29] Sembra che OspC giochi un ruolo nella trasmissione dal vettore all'ospite, dal momento che la proteina viene espressa dalla Borrelia soltanto in presenza di sangue o tessuti di mammifero.[30] Nella trasmissione all'ospite mammifero, quando la zecca ninfale comincia a nutrirsi di sangue, e le spirochete nell'intestino della zecca cominciano a moltiplicarsi rapidamente, la maggior parte delle spirochete cessa di esprimere la proteina OspA nella superficie. Simultaneamente con la scomparsa di OspA, la popolazione di spirochete nell'intestino della zecca cominciano a esprimere la OspC. L'espressione della OspC comincia durante il primo giorno dell'alimentazione ed effettua un picco 48 ore dopo la puntura.[31]
Struttura e crescita
modificaLa Borrelia burgdorferi è una spirocheta altamente specializzata, mobile, dotata di doppia membrana, che oscilla, con lunghezza che va dai 9 ai 32 micrometri. È spessa descritta come un batterio gram-negativo e possiede una membrana esterna con LPS, anche se si colora molto debolmente con la colorazione di Gram. B. burgdorferi è un organismo microaerofilo (richiede poco ossigeno per sopravvivere). Vive primariamente come un patogeno extracellulare, anche se può nascondersi intracellularmente (vedi la sezione #Meccanismi di persistenza). Come altre spirochete, ad esempio il Treponema pallidum (agente della sifilide), la B. burgdorferi contiene un filamento assiale composto di flagelli che corre per tutta la lunghezza della sua parete cellulare e della membrana esterna. Questa struttura consente alla spirocheta di muoversi efficacemente come un cavatappi attraverso un mezzo viscoso, come il tessuto connettivo. Come risultato, il B. burgdorferi si può disseminare nell'intero organismo dopo qualche giorno o settimana dell'infezione, penetrando profondamente dentro i tessuti dove il sistema immunitario e gli antibiotici possono non riuscire a eradicare l'infezione. La Borrelia burgdorferi prolifera molto lentamente, con un tempo di duplicazione di 12-18 ore[32] (a differenza di patogeni più comuni come lo streptococco oppure lo stafilococco, che hanno un tempo di divisione di 20-30 minuti). Dal momento che la gran parte degli antibiotici uccide i batteri soltanto mentre si dividono, questo tempo di duplicazione più lungo rende necessari lunghi tempi di terapia antibiotica per la cura della malattia di Lyme. Gli antibiotici sono più efficaci durante la fase di crescita, che per la B. burgdorferi avviene in cicli di quattro settimane. Alcuni clinici hanno osservato che i malati cronici del Lyme spesso soffrono un peggioramento dei sintomi ogni quattro settimane; si sospetta che questi aggravamenti ("flare-ups") periodici siano da imputare alla fase di crescita della B. burgdorferi.[33]
Meccanismi di persistenza
modificaMentre in vitro la Borrelia burgdorferi è suscettibile a un buon numero di antibiotici, vi sono rapporti molto contraddittori sulla efficacia degli antibiotici in vivo. La B. burgdorferi può persistere negli umani e negli animali per mesi o anni a dispetto di una robusta risposta immunitaria e di un trattamento antibiotico standard, particolarmente quando la terapia viene dilazionata e la disseminazione è estesa. Numerosi studi hanno dimostrato la persistenza dell'infezione anche dopo intense, prolungate e potenti terapie antibiotiche.[34][35][36][37][38][39][40][41][42] Sono state ipotizzate vari tipi di strategie di sopravvivenza della Borrelia burgdorferi, per potere spiegare questa tenace resistenza,[43] includendo le seguenti:
- Sequestro fisico della B. burgdorferi in luoghi dell'organismo che sono inaccessibili al sistema immunitario e agli antibiotici, come ad esempio il cervello[44] e il sistema nervoso centrale. Nuovi dati suggeriscono che la B. burgdorferi può utilizzare il sistema fibrinolitico dell'ospite per penetrare la barriera ematoencefalica.
- Invasione intracellulare: si è dimostrato che grazie alla sua motilità spontanea, e alla capacità di esercitare "leva" con la sua forma "a cavatappi" la B. burgdorferi riesce a penetrare all'interno di molte cellule, tra queste le cellule endoteliali,[46] i fibroblasti,
[47] i linfociti, [48] i macrofagi (che probabilmente la catturano), [49] i cheratinociti, [50] la sinovia, [51] [52] e più recentemente sono state dimostrate all'interno dei neuroni e della glia. [53] Dal momento che si 'nasconde' dentro queste cellule, la B. burgdorferi si rende capace di evadere il sistema immunitario e rimane protetto fino a un certo punto dagli antibiotici, [54] [55] e in questo modo permettono all'infezione di persistere in uno stato cronico. Paradossalmente, molti di questi studi scientifici sono stati eseguiti e pubblicati da medici e ricercatori che erano scettici riguardo alla possibilità di un'infezione persistente da Borrelia.[45]
- forme morfologicamente alterate, ad es. sferoplasti (cisti, granuli).
- L'esistenza di sferoplasti della B. burgdorferi, che mancano di una parete cellulare, è stata molto ben documentata sia in vitro,[56]
[57] [58] [59] [60] [61] [62] sia in vivo, [52] [58] [63] [64] e nel modello ex vivo (animali morti e tramite autopsia). [65] È assodato il fatto che sia richiesta energia perché il batterio passi dalla forma spirale alla forma cistica[56] suggerisce che queste forme alterate abbiano una funzione per la sopravvivenza, e che non siano dei meri stadi finali, dei prodotti di degenerazione. Gli sferoplasti sono davvero virulenti e infettivi, capaci di sopravvivere in condizioni ambientali avverse, e si è vista la loro capacità di tornare alla forma spirale in vitro, una volta che le condizioni diventavano più favorevoli. [58] [66] [67] [68] [69]
- Un certo numero di altri fattori rendono gli sferoplasti della B. burgdorferi un fattore chiave nella natura cronica, recidivante della malattia di Lyme. In confronto alla forma spirale, gli sferoplasti hanno una superficie drasticamente ridotta, e in questo modo espongono alla sorveglianza immunitaria un'area più ridotta. Inoltre esprimono diverse proteine di superficie - un'altra ragione che causa la malattia sieronegativa (ad es. test anticorpali falsi negativi), dal momento che i test correntemente utilizzati cercano anticorpi alle proteine di superficie della forma spirale. In aggiunta, gli sferoplasti della B. burgdorferi sono in genere non sensibili ai vari tipi di antibiotico tradizionalmente usati nella terapia della malattia di Lyme. Invece hanno dimostrato una certa sensibilità in vitro ai farmaci antiparassitari come il metronidazolo,[70] il tinidazolo,
[71] e l'idrossiclorochina, [72] farmaci a quali la forma batterica spirale di B. burgdorferi non è sensibile.
- Variazione antigenica. Allo stesso modo della Borrelia recurrentis che causa la febbre ricorrente, B. burgdorferi ha l'abilità di variare le sue proteine di superficie in risposta all'attacco del sistema immunitario.[43]
[73] Questa capacità è correlata alla complessità genomica della B. burgdorferi, ed è un altro modo tramite il quale la B. burgdorferi evade la sorveglianza del sistema immunitario e riesce a stabilire un'infezione cronica.
- Soppressione di vari meccanismi del sistema immunitario. Inibizione del complemento, induzione di citochine anti-infiammatorie come l'IL-10, e la formazione del complesso immune meccanismi che sono stati tutti ben documentati nell'infezione da B. burgdorferi.[43]
Inoltre, l'esistenza di complessi immuni fornisce un'ulteriore spiegazione per la malattia sieronegativa, in pazienti con esposizione alle zecche e sintomi di malattia caratteristici della borreliosi, ma che risultano sieronegativi nella risposta anticorpale presente nel sangue e nel fluido cerebrospinale), dal momento che molti studi hanno dimostrato l'esistenza di un buon numero di pazienti sieronegativi al Lyme, ma che hanno anticorpi sequestrati in questi complessi immuni.[74][75][76]
Progressi nella ricerca immunologica avanzata
modificaIl ruolo dei linfociti T nella borrelia venne scoperto per la prima volta nel 1984,[77] il ruolo dell'immunità cellulare nella malattia di Lyme attiva venne individuato nel 1986,[78] e la persistenza a lungo termine delle risposte delle cellule T linfocitarie alla B. burgdorferi come una "sindrome da cicatrice immunologica" venne ipotizzata nel 1990.[79] Il ruolo del Th1 e dell'interferone-gamma (INF-gamma) nella borreliosi venne descritto per la prima volta nel 1995.[80] La via delle citochine nella malattia di Lyme, e il ruolo del Th1 nella "down regulation" della interleuchina 10 (IL-10) venne proposta per la prima volta nel 1997.[81] Recenti studi, eseguiti sia nella forma acuta sia in quella refrattaria alla terapia antibiotica, oppure in quella cronica, hanno mostrato che la Lyme disease avvia un processo pro-infiammatorio. Questo processo pro-infiammatorio dell'immunità cellulo-mediata e risulta nella "up-regulation" della Th1. Questi studi mostrano un aumento significativo nella produzione di citochina (IL-10), una "up-regulation" della interleuchina 6 (IL-6) e dell'interleuchina 12 (Il-12) e del interferone gamma (IFN-gamma) oltre che una sregolazione nella produzione di Tumor necrosis factor-alfa, predominantemente.[82][83][84][85][86][87]
Note
modifica- ^ Bunikis J, Garpmo U, Tsao J, Berglund J, Fish D, Barbour AG, Sequence typing reveals extensive strain diversity of the Lyme borreliosis agents Borrelia burgdorferi in North America and Borrelia afzelii in Europe (PDF), in Microbiology, vol. 150, Pt 6, 2004, pp. 1741-55, PMID 15184561.
- ^ Felsenfeld O. Borrelia. Strains, vectors, human and animal borreliosis. St. Louis: Warren H. Green, Inc.; 1971
- ^ Todar's Text Book of Bacteriology: Borrelia Burgdorferi Cultivation
- ^ INFECTION AND IMMUNITY: Clonal Polymorphism of Borrelia burgdorferi Strain B31 MI: Implications for Mutagenesis in an Infectious Strain Background Archiviato il 26 giugno 2017 in Internet Archive.
- ^ JOURNAL OF BACTERIOLOGY: A Second Allele of eppA in Borrelia burgdorferi Previously Undetected Circular Plasmid burgdorferi Strain B31 Is Located on the cp9-2 Archiviato il 24 luglio 2018 in Internet Archive. - Miller, James L. Bono, Kelly Babb, Nazira cp9-2
- ^ van der Heijden, I. M., B. Wilbrink, S. G. Rijpkema, L. M. Schouls, P. H. Heymans, J. D. van Embden, F. C. Breedveld, and P. P. Tak. 1999. Detection of Borrelia burgdorferi sensu stricto by reverse line blot in the joints of Dutch patients with Lyme arthritis. Arthritis Rheum. 42:1473–1480.
- ^ Vasiliu, V., P. Herzer, D. Rossler, G. Lehnert, and B. Wilske. 1998. Heterogeneity of Borrelia burgdorferi sensu lato demonstrated by an ospA-type-specific PCR in synovial fluid from patients with Lyme arthritis. Med. Microbiol. Immunol. 187:97–102
- ^ Wang G, van Dam AP, Le Fleche A, Postic D, Peter O, Baranton G, de Boer R, Spanjaard L, Dankert J.Genetic and phenotypic analysis of Borrelia valaisiana sp. nov. (Borrelia genomic groups VS116 and M19). Int J Syst Bacteriol. 1997 Oct;47(4):926-32
- ^ Diza E, Papa A, Vezyri E, Tsounis S, Milonas I, Antioniadis A., Borrelia valaisiana in cerebrospinal fluid [letter]., in Emerg Infect Dis, vol. 10, n. 9, 2004, pp. 1692-3, PMID 15503409.
- ^ Masuzawa T. Terrestrial distribution of the Lyme borreliosis agent Borrelia burgdorferi sensu lato in East Asia. Jpn J Infect Dis. 2004 Dec;57(6):229-35.
- ^ Wang DM, Hao Q, Cai XH, Wan KL, Wang ZX, Chen J. Study on ribotyping of Lyme borreliosis spirochete in Guizhou province. Zhonghua Liu Xing Bing Xue Za Zhi. 2003 Dec;24(12):1129-31.
- ^ Collares-Pereira M, Couceiro S, Franca I, Kurtenbach K, Schafer SM, Vitorino L, Goncalves L, Baptista S, Vieira ML, Cunha C, First isolation of Borrelia lusitaniae from a human patient (PDF), in J Clin Microbiol, vol. 42, n. 3, 2004, pp. 1316-8, PMID 15004107. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 27 settembre 2006).
- ^ Postic D, Ras NM, Lane RS, Hendson M, Baranton G, Expanded diversity among Californian borrelia isolates and description of Borrelia bissettii sp. nov. (formerly Borrelia group DN127) (PDF), in J Clin Microbiol, vol. 36, n. 12, 1998, pp. 3497-504, PMID 9817861. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 27 settembre 2006).
- ^ Maraspin V, Cimperman J, Lotric-Furlan S, Ruzic-Sabljic E, Jurca T, Picken RN, Strle F, Solitary borrelial lymphocytoma in adult patients, in Wien Klin Wochenschr, vol. 114, n. 13-14, 2002, pp. 515-23, PMID 12422593.
- ^ Richter D, Postic D, Sertour N, Livey I, Matuschka FR, Baranton G, Delineation of Borrelia burgdorferi sensu lato species by multilocus sequence analysis and confirmation of the delineation of Borrelia spielmanii sp. nov, in Int J Syst Evol Microbiol, vol. 56, Pt 4, 2006, pp. 873-81, PMID 16585709.
- ^ Foldvari G, Farkas R, Lakos A, Borrelia spielmanii erythema migrans, Hungary, in Emerg Infect Dis, vol. 11, n. 11, 2005, pp. 1794-5, PMID 16422006.
- ^ Scoles GA, Papero M, Beati L, Fish D, A relapsing fever group spirochete transmitted by Ixodes scapularis ticks, in Vector Borne Zoonotic Dis, vol. 1, n. 1, 2001, pp. 21-34, PMID 12653133.
- ^ Bunikis J, Tsao J, Garpmo U, Berglund J, Fish D, Barbour AG, Typing of Borrelia relapsing fever group strains, in Emerg Infect Dis, vol. 10, n. 9, 2004, pp. 1661-4, PMID 15498172.
- ^ Varela AS, Luttrell MP, Howerth EW, Moore VA, Davidson WR, Stallknecht DE, Little SE, First culture isolation of Borrelia lonestari, putative agent of southern tick-associated rash illness (PDF), in J Clin Microbiol, vol. 42, n. 3, 2004, pp. 1163-9, PMID 15004069. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 27 settembre 2006).
- ^ (EN) Borrelia lonestari DNA in Adult Amblyomma americanum Ticks, Alabama - Statistical Data Included, su healthdir.vancouver.bc.ca. URL consultato il 17 febbraio 2021 (archiviato dall'url originale il 9 luglio 2012).
- ^ WWW.MYFOXHOUSTON.COM: Lyme disease not so rare in Texas, study says Archiviato il 10 giugno 2012 in Internet Archive.
- ^ Brazilian Journal of Medical and Biological Research: Description of Lyme disease-like syndrome in Brazil. Is it a new tick borne disease or Lyme disease variation?
- ^ Masters E, Granter S, Duray P, Cordes P, Physician-diagnosed erythema migrans and erythema migrans-like rashes following Lone Star tick bites, in Arch Dermatol, vol. 134, n. 8, 1998, pp. 955-60, PMID 9722725.
- ^ Porcella SF, Schwan TG, Borrelia burgdorferi and Treponema pallidum: a comparison of functional genomics, environmental adaptations, and pathogenic mechanisms, in J Clin Invest, vol. 107, n. 6, 2001, pp. 651-6, PMID 11254661.
- ^ Casjens S, Palmer N, van Vugt R, Huang WM, Stevenson B, Rosa P, Lathigra R, Sutton G, Peterson J, Dodson RJ, Haft D, Hickey E, Gwinn M, White O, Fraser CM, A bacterial genome in flux: the twelve linear and nine circular extrachromosomal DNAs in an infectious isolate of the Lyme disease spirochete Borrelia burgdorferi, in Mol Microbiol, vol. 35, n. 3, 2000, pp. 490-516, DOI:10.1046/j.1365-2958.2000.01698.x, PMID 10672174.
- ^ Qiu WG, Schutzer SE, Bruno JF, Attie O, Xu Y, Dunn JJ, Fraser CM, Casjens SR, Luft BJ, Genetic exchange and plasmid transfers in Borrelia burgdorferi sensu stricto revealed by three-way genome comparisons and multilocus sequence typing (PDF), in Proc Natl Acad Sci U S A, vol. 101, n. 39, 2004, pp. 14150-5, PMID 15375210.
- ^ K. "Lyme borreliosis: review of present knowledge" Cesk Epidemiol Mikrobiol Imunol. 1993 Jun;42(2):87-92
- ^ Bergstrom S., Bundoc V.G., Barbour A.G. Molecular analysis of linear plasmid-encoded major surface proteins, OspA and OspB, of the Lyme disease spirochaete Borrelia burgdorferi. Mol. Microbiol. 3 479-486 1989
- ^ Girschick, J. e Singh, S.E. Molecular survival strategies of the lyme disease spirochete Borrelia burgdorferi. Sep, 2004. The Lancet Infectious Diseases: Volume 4, numero 9, settembre 2004, pp. 575-583.
- ^ Fikrig, E. e Pal, U. Adaptation of Borrelia burgdorferi in the vector and vertebrate host. Microbes and Infection Volume 5, numero 7, giugno 2003, pp. 659-666. PMID 12787742
- ^ Schwan TG, Piesman J. Temporal changes in outer surface proteins A and C of the Lyme disease-associated spirochete, Borrelia burgdorferi, during the chain of infection in ticks and mice. J Clin Microbiol 2000;38:382-8.
- ^ Kelly, R. T. (1984). Genus IV. Borrelia Swellengrebel 1907, 582AL. In Bergey's Manual of Systematic Bacteriology, vol. 1, pp. 57–62. Edited by N. R. Krieg & J. G. Holt. Baltimore: Williams & Wilkins.
- ^ Burrascano JJ, Diagnostic hints and treatment guidelines for Lyme and other tick borne illnesses (PDF), 15ª ed., 2005. URL consultato il 1º maggio 2006 (archiviato dall'url originale il 22 aprile 2007).
- ^ Nocton JJ, Dressler F, Rutledge BJ, Rys PN, Persing DH, Steere AC, Detection of Borrelia burgdorferi DNA by polymerase chain reaction in synovial fluid from patients with Lyme arthritis, in N Engl J Med, vol. 330, n. 4, 1994, pp. 229-34, PMID 8272083.
- ^ Bayer ME, Zhang L, Bayer MH, Borrelia burgdorferi DNA in the urine of treated patients with chronic Lyme disease symptoms. A PCR study of 97 cases, in Infection, vol. 24, n. 5, 1996, pp. 347-53, PMID 8923044.
- ^ Preac-Mursic V, Weber K, Pfister HW, Wilske B, Gross B, Baumann A, Prokop J, Survival of Borrelia burgdorferi in antibiotically treated patients with Lyme borreliosis, in Infection, vol. 17, n. 6, 1989, pp. 355-9, PMID 2613324.
- ^ Pfister HW, Preac-Mursic V, Wilske B, Schielke E, Sorgel F, Einhaupl KM, Randomized comparison of ceftriaxone and cefotaxime in Lyme neuroborreliosis, in J Infect Dis, vol. 163, n. 2, 1991, pp. 311-8, PMID 1988514.
- ^ Oksi J, Marjamaki M, Nikoskelainen J, Viljanen MK, Borrelia burgdorferi detected by culture and PCR in clinical relapse of disseminated Lyme borreliosis, in Ann Med, vol. 31, n. 3, 1999, pp. 225-32, PMID 10442678.
- ^ Hudson BJ, Stewart M, Lennox VA, Fukunaga M, Yabuki M, Macorison H, Kitchener-Smith J, Culture-positive Lyme borreliosis, in Med J Aust, vol. 168, n. 10, 1998, pp. 500-2, PMID 9631675.
- ^ Lawrence C, Lipton RB, Lowy FD, Coyle PK, Seronegative chronic relapsing neuroborreliosis, in Eur Neurol, vol. 35, n. 2, 1995, pp. 113-7, PMID 7796837.
- ^ Honegr K, Hulinska D, Dostal V, Gebousky P, Hankova E, Horacek J, Vyslouzil L, Havlasova J, [Persistence of Borrelia burgdorferi sensu lato in patients with Lyme borreliosis], in Epidemiol Mikrobiol Imunol, vol. 50, n. 1, 2001, pp. 10-6, PMID 11233667.
- ^ Straubinger RK, Summers BA, Chang YF, Appel MJ, Persistence of Borrelia burgdorferi in experimentally infected dogs after antibiotic treatment (PDF), in J Clin Microbiol, vol. 35, n. 1, 1997, pp. 111-6, PMID 8968890. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 27 settembre 2006).
- ^ a b c Embers ME, Ramamoorthy R, Philipp MT, Survival strategies of Borrelia burgdorferi, the etiologic agent of Lyme disease, in Microbes Infect, vol. 6, n. 3, 2004, pp. 312-8, PMID 15065567.
- ^ Miklossy J, Khalili K, Gern L, Ericson RL, Darekar P, Bolle L, Hurlimann J, Paster BJ, Borrelia burgdorferi persists in the brain in chronic lyme neuroborreliosis and may be associated with Alzheimer disease, in J Alzheimers Dis, vol. 6, n. 6, 2004, pp. 639-49; discussion 673-81, PMID 15665404.
- ^ a b Grab DJ, Perides G, Dumler JS, Kim KJ, Park J, Kim YV, Nikolskaia O, Choi KS, Stins MF, Kim KS, Borrelia burgdorferi, host-derived proteases, and the blood-brain barrier, in Infect Immun, vol. 73, n. 2, 2005, pp. 1014-22, PMID 15664945. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 12 settembre 2007).
- ^ Ma Y, Sturrock A, Weis JJ, Intracellular localization of Borrelia burgdorferi within human endothelial cells (PDF) [collegamento interrotto], in Infect Immun, vol. 59, n. 2, 1991, pp. 671-8, PMID 1987083.
- ^ Klempner MS, Noring R, Rogers RA, Invasion of human skin fibroblasts by the Lyme disease spirochete, Borrelia burgdorferi, in J Infect Dis, vol. 167, n. 5, 1993, pp. 1074-81, PMID 8486939.
- ^ Dorward DW, Fischer ER, Brooks DM, Invasion and cytopathic killing of human lymphocytes by spirochetes causing Lyme disease, in Clin Infect Dis, 25 Suppl 1, 1997, pp. S2-8, PMID 9233657.
- ^ Montgomery RR, Nathanson MH, Malawista SE, The fate of Borrelia burgdorferi, the agent for Lyme disease, in mouse macrophages. Destruction, survival, recovery, in J Immunol, vol. 150, n. 3, 1993, pp. 909-15, PMID 8423346.
- ^ Aberer E, Kersten A, Klade H, Poitschek C, Jurecka W, Heterogeneity of Borrelia burgdorferi in the skin, in Am J Dermatopathol, vol. 18, n. 6, 1996, pp. 571-9, PMID 8989928.
- ^ Girschick HJ, Huppertz HI, Russmann H, Krenn V, Karch H, Intracellular persistence of Borrelia burgdorferi in human synovial cells, in Rheumatol Int, vol. 16, n. 3, 1996, pp. 125-32, PMID 8893378.
- ^ a b Nanagara R, Duray PH, Schumacher HR Jr, Ultrastructural demonstration of spirochetal antigens in synovial fluid and synovial membrane in chronic Lyme disease: possible factors contributing to persistence of organisms, in Hum Pathol, vol. 27, n. 10, 1996, pp. 1025-34, PMID 8892586.
- ^ Livengood JA, Gilmore RD, Invasion of human neuronal and glial cells by an infectious strain of Borrelia burgdorferi., in Microbes Infect, [Epub ahead of print], 2006, PMID 17045505.
- ^ Georgilis K, Peacocke M, Klempner MS, Fibroblasts protect the Lyme disease spirochete, Borrelia burgdorferi, from ceftriaxone in vitro, in J Infect Dis, vol. 166, n. 2, 1992, pp. 440-4, PMID 1634816.
- ^ Brouqui P, Badiaga S, Raoult D, Eucaryotic cells protect Borrelia burgdorferi from the action of penicillin and ceftriaxone but not from the action of doxycycline and erythromycin (PDF), in Antimicrob Agents Chemother, vol. 40, n. 6, 1996, pp. 1552-4, PMID 8726038. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 3 aprile 2007).
- ^ a b Alban PS, Johnson PW, Nelson DR, Serum-starvation-induced changes in protein synthesis and morphology of Borrelia burgdorferi, in Microbiology, 146 ( Pt 1), 2000, pp. 119-27, PMID 10658658, Full Text.
- ^ Benach JL, Functional heterogeneity in the antibodies produced to Borrelia burgdorferi, in Wien Klin Wochenschr, vol. 111, n. 22-23, 1999, pp. 985-9, PMID 10666815.
- ^ a b c Mursic VP, Wanner G, Reinhardt S, Wilske B, Busch U, Marget W, Formation and cultivation of Borrelia burgdorferi spheroplast-L-form variants, in Infection, vol. 24, n. 3, 1996, pp. 218-26, PMID 8811359.
- ^ Cluss RG, Goel AS, Rehm HL, Schoenecker JG, Boothby JT, Coordinate synthesis and turnover of heat shock proteins in Borrelia burgdorferi: degradation of DnaK during recovery from heat shock (PDF), in Infect Immun, vol. 64, n. 5, 1996, pp. 1736-43, PMID 8613385. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 27 settembre 2006).
- ^ Kersten A, Poitschek C, Rauch S, Aberer E, Effects of penicillin, ceftriaxone, and doxycycline on morphology of Borrelia burgdorferi (PDF), in Antimicrob Agents Chemother, vol. 39, n. 5, 1995, pp. 1127-33, PMID 7625800. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 5 ottobre 2006).
- ^ Angelov L, Dimova P, Berbencova W, Clinical and laboratory evidence of the importance of the tick D. marginatus as a vector of B. burgdorferi in some areas of sporadic Lyme disease in Bulgaria, in Eur J Epidemiol, vol. 12, n. 5, 1996, pp. 499-502, PMID 8905312.
- ^ Schaller M, Neubert U, Ultrastructure of Borrelia burgdorferi after exposure to benzylpenicillin, in Infection, vol. 22, n. 6, 1994, pp. 401-6, PMID 7698837.
- ^ Phillips SE, Mattman LH, Hulinska D, Moayad H, A proposal for the reliable culture of Borrelia burgdorferi from patients with chronic Lyme disease, even from those previously aggressively treated, in Infection, vol. 26, n. 6, 1998, pp. 364-7, PMID 9861561.
- ^ Hulinska D, Bartak P, Hercogova J, Hancil J, Basta J, Schramlova J, Electron microscopy of Langerhans cells and Borrelia burgdorferi in Lyme disease patients, in Zentralbl Bakteriol, vol. 280, n. 3, 1994, pp. 348-59, PMID 8167429.
- ^ Duray PH, Yin SR, Ito Y, Bezrukov L, Cox C, Cho MS, Fitzgerald W, Dorward D, Zimmerberg J, Margolis L, Invasion of human tissue ex vivo by Borrelia burgdorferi, in J Infect Dis, vol. 191, n. 10, 2005, pp. 1747-54, PMID 15838803.
- ^ Brorson O, Brorson SH, Transformation of cystic forms of Borrelia burgdorferi to normal, mobile spirochetes, in Infection, vol. 25, n. 4, 1997, pp. 240-6, PMID 9266264.
- ^ Brorson O, Brorson SH, In vitro conversion of Borrelia burgdorferi to cystic forms in spinal fluid, and transformation to mobile spirochetes by incubation in BSK-H medium, in Infection, vol. 26, n. 3, 1998, pp. 144-50, PMID 9646104.
- ^ Gruntar I, Malovrh T, Murgia R, Cinco M, Conversion of Borrelia garinii cystic forms to motile spirochetes in vivo, in APMIS, vol. 109, n. 5, 2001, pp. 383-8, PMID 11478686.
- ^ Murgia R, Cinco M, Induction of cystic forms by different stress conditions in Borrelia burgdorferi, in APMIS, vol. 112, n. 1, 2004, pp. 57-62, PMID 14961976.
- ^ Brorson O, Brorson SH, An in vitro study of the susceptibility of mobile and cystic forms of Borrelia burgdorferi to metronidazole, in APMIS, vol. 107, n. 6, 1999, pp. 566-76, PMID 10379684.
- ^ Brorson O, Brorson SH, An in vitro study of the susceptibility of mobile and cystic forms of Borrelia burgdorferi to tinidazole (PDF), in Int Microbiol, vol. 7, n. 2, 2004, pp. 139-42, PMID 15248163. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 1º gennaio 2007).
- ^ Brorson O, Brorson SH, An in vitro study of the susceptibility of mobile and cystic forms of Borrelia burgdorferi to hydroxychloroquine, in Int Microbiol, vol. 5, n. 1, 2002, pp. 25-31, PMID 12102233.
- ^ Liang FT, Yan J, Mbow ML, Sviat SL, Gilmore RD, Mamula M, Fikrig E, Borrelia burgdorferi changes its surface antigenic expression in response to host immune responses, in Infect Immun, vol. 72, n. 10, 2004, pp. 5759-67, PMID 15385475. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 27 settembre 2006).
- ^ Schutzer SE, Coyle PK, Reid P, Holland B, Borrelia burgdorferi-specific immune complexes in acute Lyme disease, in JAMA, vol. 282, n. 20, 1999, pp. 1942-6, PMID 10580460.
- ^ Coyle PK, Schutzer SE, Belman AL, Krupp LB, Golightly MG, Cerebrospinal fluid immune complexes in patients exposed to Borrelia burgdorferi: detection of Borrelia-specific and -nonspecific complexes, in Ann Neurol, vol. 28, n. 6, 1990, pp. 739-44, PMID 2285261.
- ^ Schutzer SE, Coyle PK, Belman AL, Golightly MG, Drulle J, Sequestration of antibody to Borrelia burgdorferi in immune complexes in seronegative Lyme disease, in Lancet, vol. 335, n. 8685, 1990, pp. 312-5, PMID 1967770.
- ^ Newman K Jr, Johnson RC."T-cell-independent elimination of Borrelia turicatae". Infect Immun. 1984 Sep;45(3):572-6.
- ^ Dattwyler RJ, Thomas JA, Benach JL, Golightly MG."Cellular immune response in Lyme disease: the response to mitogens, live Borrelia burgdorferi, NK cell function and lymphocyte subsets". Zentralbl Bakteriol Mikrobiol Hyg [A]. 1986 Dec;263(1-2):151-9
- ^ Kruger H, Pulz M, Martin R, Sticht-Groh V. "Long-term persistence of specific T- and B-lymphocyte responses to Borrelia burgdorferi following untreated neuroborreliosis". Infection. 1990 Sep-Oct;18(5):263-7.
- ^ Forsberg P, Ernerudh J, Ekerfelt C, Roberg M, Vrethem M, Bergstrom S. "The outer surface proteins of Lyme disease borrelia spirochetes stimulate T cells to secrete interferon-gamma (IFN-gamma): diagnostic and pathogenic implication". Clin Exp Immunol. 1995 Sep;101(3):453-60.
- ^ Yin Z, Braun J, Neure L, Wu P, Eggens U, Krause A, Kamradt T, Sieper J. "T cell cytokine pattern in the joints of patients with Lyme arthritis and its regulation by cytokines and anticytokines". Arthritis Rheum. 1997 Jan;40(1):69-79.
- ^ Shin JJ, Glickstein LJ, Steere AC. "High levels of inflammatory chemokines and cytokines in joint fluid and synovial tissue throughout the course of antibiotic-refractory lyme arthritis". Arthritis Rheum. 2007 Mar 28;56(4):1325-1335
- ^ Kisand KE, Prukk T, Kisand KV, Luus SM, Kalbe I, Uibo R. "Propensity to excessive proinflammatory response in chronic Lyme borreliosis". APMIS. 2007 Feb;115(2):134-41.
- ^ Dame TM, Orenzoff BL, Palmer LE, Furie MB. "IFN-gamma alters the response of Borrelia burgdorferi-activated endothelium to favor chronic inflammation". J Immunol. 2007 Jan 15;178(2):1172-9.
- ^ Dennis VA, Jefferson A, Singh SR, Ganapamo F, Philipp MT. "Interleukin-10 anti-inflammatory response to Borrelia burgdorferi, the agent of Lyme disease: a possible role for suppressors of cytokine signaling 1 and 3". Infect Immun. 2006 Oct;74(10):5780-9.
- ^ Ghosh S, Seward R, Costello CE, Stollar BD, Huber BT "Autoantibodies from synovial lesions in chronic, antibiotic treatment-resistant Lyme arthritis bind cytokeratin-10". J Immunol. 2006 Aug 15;177(4):2486-94.
- ^ Rasley A, Anguita J, Marriott I. "Borrelia burgdorferi induces inflammatory mediator production by murine microglia". J Neuroimmunol. 2002 Sep;130(1-2):22-31.
Voci correlate
modificaAltri progetti
modificaWikimedia Commons contiene immagini o altri file su Borrelia
Collegamenti esterni
modifica- NCBI Taxonomy Browser - Borrelia, su ncbi.nlm.nih.gov.
- Borrelia burgdoferi B31 Genome Page, su cmr.jcvi.org. URL consultato il 27 giugno 2009 (archiviato dall'url originale il 27 giugno 2009).
- Borrelia Garinii PBi Genome Page, su cmr.jcvi.org. URL consultato il 3 novembre 2011 (archiviato dall'url originale il 30 giugno 2009).
- Borrelia Afzelli PKo Genome Page, su cmr.jcvi.org. URL consultato il 3 novembre 2011 (archiviato dall'url originale il 26 agosto 2009).
- University of Calgary Bacterial Pathogenesis Research Group - George Chaconas, PhD, su med.ucalgary.ca. URL consultato il 12 aprile 2007 (archiviato dall'url originale il 7 marzo 2007).
- Associazione Italiana malati di Lyme, su lymeitalia.altervista.org.
| Controllo di autorità | Thesaurus BNCF 64629 · LCCN (EN) sh87003149 · GND (DE) 4389619-4 · BNF (FR) cb12450722d (data) · J9U (EN, HE) 987007534486505171 |
|---|
