Fotochimica
La fotochimica è una branca della chimica che si occupa delle reazioni chimiche indotte dall'interazione della luce (in particolare ultravioletto, luce visibile e il vicino infrarosso) con la materia.
Le reazioni fotochimiche sono preziose nella chimica organica e in quella inorganica perché procedono in modo diverso rispetto alle reazioni termiche. In esse l'energia necessaria per lo svolgersi della reazione chimica è fornita quindi dai fotoni assorbiti dai reagenti, che portano dei particolari gruppi chimici detti cromofori, in grado di assorbire la luce. I fotocatalizzatori sono opportuni catalizzatori che vengono attivati con la luce.
Molti processi importanti coinvolgono la fotochimica. Molte reazioni redox sono catalizzate dalla luce, mentre un esempio notevole delle possibilità della fotochimica è quello della fotosintesi clorofilliana, in cui le piante formano amido e ossigeno partendo dall'acqua e dall'anidride carbonica grazie ai processi della luce sulla clorofilla.
Principi
[modifica | modifica wikitesto]Due leggi fondamentali della fotochimica sono le seguenti:
- legge di Grotthus-Draper: quando un fascio di luce incide sui reagenti, solamente le lunghezze d'onda assorbite portano alla reazione chimica;
- legge di Stark-Einstein: per ogni quanto di energia assorbita reagirà una molecola. Fanno eccezione i processi in cui viene utilizzata luce laser, che possono essere bifotonici o multi fotone.
La luce è un tipo di radiazione elettromagnetica, una fonte di energia. La legge di Grotthus-Draper (dai chimici Theodor Grotthuss e John W. Draper), afferma che la luce deve essere assorbita da una sostanza chimica perché abbia luogo una reazione fotochimica. Per ogni fotone di luce assorbito da un sistema chimico, non più di una molecola è attivata per una reazione fotochimica, come definito dalla resa quantica.
Le reazioni chimiche si verificano solo quando a una molecola viene fornita la necessaria "energia di attivazione". Un semplice esempio può essere la combustione di benzina (un idrocarburo) in anidride carbonica e acqua. In questa reazione, l'energia di attivazione viene fornita sotto forma di calore o di una scintilla. In caso di reazioni fotochimiche la luce fornisce l'energia di attivazione. Semplificando, la luce è un meccanismo che fornisce l'energia di attivazione necessaria per molte reazioni. Se viene impiegato un laser, è possibile eccitare selettivamente una molecola in modo da produrre lo stato elettronico e vibrazionale desiderato. Allo stesso modo, l'emissione da uno stato particolare, può essere selettivamente monitorato, fornendo una misura di quello stato. Se il sistema chimico è a bassa pressione, questo consente agli scienziati di osservare la distribuzione di energia dei prodotti di una reazione chimica prima che le differenze di energia vengano spalmate ed entrino nella media a causa delle ripetute collisioni.
L'assorbimento di un fotone di luce da una molecola reagente può anche consentire che una reazione avvenga non solo portando la molecola alla necessaria energia di attivazione, ma anche cambiando la simmetria della configurazione elettronica della molecola, che consente un percorso di reazione altrimenti inaccessibile, come descritto dalle regole di Woodward-Hoffmann. Una reazione di cicloaddizione [2+2] è un esempio di reazione periciclica che può essere analizzata utilizzando queste regole o la teoria degli orbitali molecolari.
Le reazioni fotochimiche implicano la riorganizzazione elettronica iniziata dalla radiazione elettromagnetia. Le reazioni sono diversi ordini di grandezza più veloce delle reazioni termiche; spesso sono osservate reazioni con una velocità di 10 −9 secondi e processi associati con una velocità di 10 −15 secondi.
Regioni spettrali
[modifica | modifica wikitesto]I fotochimici in genere utilizzano solo alcune sezioni dello spettro elettromagnetico. Alcune delle sezioni più utilizzate, e le loro lunghezze d'onda, sono le seguenti:
- UV: 100-400 nm
- Spettro visibile: 400-700 nm
- Vicino all'infrarosso: 700-2500 nm
Reazioni fotosintetiche in natura
[modifica | modifica wikitesto]L'esempio principale è la fotosintesi, in cui la maggior parte delle piante usa l'energia solare per convertire il diossido di carbonio e l'acqua in glucosio, producendo l'ossigeno come un prodotto collaterale.
Gli esseri umani si basano sulla fotochimica per la biosintesi della vitamina D.
La visione avviene grazie ad una reazione fotochimica della rodopsina.[1]
Nelle lucciole, un enzima nell'addome catalizza una reazione che si traduce in bioluminescenza.[2]
Applicazioni tecniche
[modifica | modifica wikitesto]Processi fotochimici sono utilizzati nella produzione delle pellicole fotografiche che è ricoperta da una gelatina contenente piccoli granuli di bromuro di argento che avvia la reazione quando la luce colpisce la pellicola. In questo caso il bromuro si dice "sensibilizzato". La reazione porta alla conversione del bromuro d'argento in argento metallico. Per eliminare le particelle di bromuro non sensibilizzato si utilizzano poi i cosiddetti "fissatori" o "fissaggi", delle sostanze chimiche.
Anche nella carta per cianografie, ricoperta di citrato di ferroammonio e ferricianuro, avviene una reazione fotochimica simile a quella delle pellicole fotografiche. I citrati, una volta colpiti dalla luce si trasformano in un ferricianuro di colore azzurro intenso.
Le reazioni fotochimiche sono non solo molto utili ma possono essere anche molto fastidiose o dannose, come nei casi di fotodegradazione di molti materiali. I tessuti scuri vengono ad esempio sbiaditi dalla luce del sole. I contenitori in vetro di farmaci sono spesso realizzati con vetro oscurato per evitare che la fotodegradazione dei farmaci.
Molte polimerizzazioni vengono avviate da fotoiniziatori che si decompongono assorbendo la luce per produrre i radicali liberi per la polimerizzazione radicalica.
Una reazione pervasiva è la generazione di ossigeno singoletto da reazioni fotosensibilizzate di ossigeno tripletto. Fotosensibilizzatori tipici includono il tetrafenilporfirina e blu di metilene. L'ossigeno singoletto che ne risulta è un ossidante aggressivo, capace di convertire legami CH in gruppi C-OH.
Nella terapia fotodinamica, la luce viene utilizzata per distruggere i tumori attraverso l'azione dell'ossigeno singoletto.
Una applicazione su larga scala della fotochimica è la tecnologia del photoresist, utilizzata nella produzione di componenti microelettronici.
Esperimenti
[modifica | modifica wikitesto]
Le reazioni fotochimiche richiedono una sorgente di luce che emette lunghezze d'onda corrispondenti ad una transizione elettronica nel reagente. Nei primi esperimenti sulle reazioni fotochimiche, così come nella vita quotidiana, la fonte di luce era la luce solare, sebbene questa sia policromatica. In laboratorio sono comuni le lampade a vapori di mercurio. Le lampade a vapori di mercurio a bassa pressione emettono principalmente a 254 nm. Per le fonti policromatiche, le variazioni di lunghezza d'onda possono essere selezionate usando i filtri. In alternativa, le lampade a LED e i Rayonet producono emissioni monocromatiche.
La luce emessa deve ovviamente raggiungere il gruppo funzionale senza essere bloccata dal reattore o da altri gruppi funzionali presenti. Per molte applicazioni, il quarzo viene usato per i reattori e per contenere la lampada. Il Pyrex assorbe a lunghezze d'onda inferiori ai 275 nm. Il solvente è un importante parametro sperimentale. I solventi sono reagenti potenziali e per questo motivo i solventi clorurati vengono evitati perché il legame C-Cl può portare alla clorazione del substrato. I solventi molto assorbenti possono prevenire il raggiungimento del substrato da parte dei fotoni. I solventi di idrocarburi assorbono solo a lunghezze d'onda corte e sono pertanto preferiti per gli esperimenti fotochimici che richiedono fotoni ad alta energia. I solventi contenenti soluzioni sature assorbono a lunghezze d'onda lunghe e possono filtrare le lunghezze d'onda corte.
Reazioni fotochimiche
[modifica | modifica wikitesto]- Cicloaddizione [2+2] fotochimica;
- Reazioni di addizione e sostituzione radicalica (alogenazione degli alcani);
- Fotoisomerizzazione;
- Fotodimerizzazione: l'irradiazione di un composto carbonilico α,β-insaturo o di un poliene coniugato produce un dimero ciclico (cicloaddizione);
- Fotolisi;
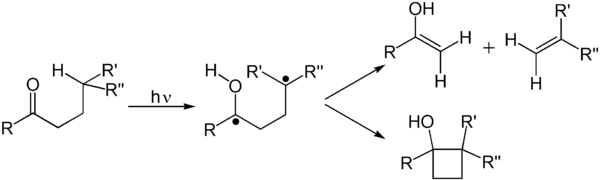
- Reazioni di Norrish;
- Accoppiamento fotoriduttivo.
Note
[modifica | modifica wikitesto]- ^ Christophe Dugave Cis-trans isomerization in biochemistry, Wiley-VCH, 2006 ISBN 3-527-31304-4 p. 56
- ^ David Stanley Saunders Insect clocks, Elsevier, 2002, ISBN 0-444-50407-9 p. 179
Bibliografia
[modifica | modifica wikitesto]- P. Atkins, J. De Paula, "Physical Chemistry", Oxford University Press, 2006 (ottava ed.), ISBN 978-0-19-870072-2
- V. Balzani, P. Ceroni, A. Juris, "Photochemistry and Photophysics: concepts, research, applications", Wiley, 2014, ISBN 978-3-527-33479-7
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto]Wikizionario contiene il lemma di dizionario «fotochimica»
Wikimedia Commons contiene immagini o altri file su fotochimica
Collegamenti esterni
[modifica | modifica wikitesto]- fotochimica, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) photochemistry, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) IUPAC Gold Book, "photochemistry", su goldbook.iupac.org.
- Fotochimica, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | Thesaurus BNCF 19320 · LCCN (EN) sh85101143 · GND (DE) 4045873-8 · BNF (FR) cb11933110s (data) · J9U (EN, HE) 987007543641305171 · NDL (EN, JA) 00566236 |
|---|