Bronchopneumopathie chronique obstructive
| Causes | Fumer ou poussière |
|---|---|
| Symptômes | Dyspnée, toux et sibilance |
| Traitement | Traitement symptomatique |
|---|---|
| Médicament | (RS)-clenbuterol, maléate d'indacatérol (d), Furoate de fluticasone, ambroxol, indacatérol, glycopyrronium (d), formotérol, erdostéine (en), bambutérol, L-carbocystéine et etofylline (d) |
| Spécialité | Pneumologie |
| CISP-2 | R95 |
|---|---|
| CIM-10 | J40 - J44, J47 |
| CIM-9 | 490 - 492, 494 - 496 |
| OMIM | 606963 |
| DiseasesDB | 2672 |
| MedlinePlus | 000091 |
| eMedicine |
807143 emerg/99 |
| MeSH | D029424 |
| MeSH | C08.381.495.389 |
| Patient UK | Chronic-obstructive-pulmonary-disease-pro |
La bronchopneumopathie chronique obstructive, abrégée BPCO, est un des groupes de maladies chroniques systémiques respiratoires, affectant en général les bronches puis les poumons. Au Canada, la maladie est aussi appelée maladie pulmonaire obstructive chronique (MPOC)[1].
Sa prévalence est difficile à estimer à cause du sous-diagnostic, mais elle constitue la troisième cause de décès dans le monde avec 3,23 millions de décès en 2019, touchant pour 80 % des pays peu ou moyennement développés[2]. En France, cette pathologie aurait fortement augmenté depuis quelques décennies (probablement pour partie en lien avec le vieillissement de la population, le tabagisme et la pollution de l'air[3]). C'est l'une des causes possibles de la mort subite de l'adulte[4].
80 % des cas de BPCO seraient imputables au tabac[5].
Définition
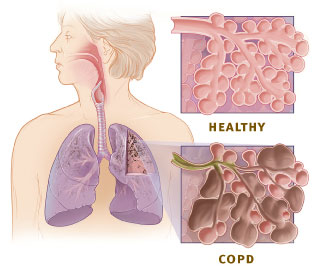
[modifier | modifier le code]Au niveau respiratoire, la BPCO est caractérisée par une obstruction lente et progressive des voies aériennes[6] et des poumons, associée à une distension permanente des alvéoles pulmonaires avec destruction des parois alvéolaires. La BPCO est caractérisée par la diminution non complètement réversible des débits expiratoires[7],[8],[9]. Elle est classiquement associée à la bronchite chronique et à l'emphysème pulmonaire[10],[11].
On soupçonne que l'inflammation chronique des poumons entraîne les dysfonctionnements constatés au niveau musculaire. Chez le patient atteint de BPCO, le métabolisme anaérobie se retrouve préférentiellement sollicité, au détriment du métabolisme aérobie. La surutilisation de cette filière énergétique entraîne une hyperlactatémie et une acidose chronique. Par effet de rétrocontrôle, l'hyperlactatémie va déclencher une augmentation de la fréquence respiratoire et une aggravation de la dyspnée. L'entretien et la restauration du fonctionnement du métabolisme aérobie apparaît aujourd'hui comme un enjeu majeur de réadaptation en faveur de la qualité de vie des patients souffrant de BPCO.
Les causes principales de cette maladie sont le tabagisme (cause la mieux documentée)[7],[12] et d'autres formes de pollution de l'air[13] « la fraction de risque attribuable aux expositions professionnelles » était évaluée par des épidémiologistes entre 15 et 20 %[13]. La pollution de l'air est aussi un facteur aggravant, et il semblerait que notre modèle de production (brûlage d'hydrocarbures, pesticides, pollutions de l'eau, diffusion de méthane en masse provoquant l'effet de serre, etc.) n'aille pas dans un sens où les BPCO pourraient diminuer[14]. Des différences et similitudes existent entre les BPCO d'origine tabagique et professionnelles[15].
Synonymes
[modifier | modifier le code]- broncho-pneumopathie obstructive ;
- broncho-pneumopathie chronique obstructive (BPCO).
Diagnostic
[modifier | modifier le code]Le diagnostic précis est basé sur les valeurs d'une épreuve fonctionnelle respiratoire qui quantifie l'obstruction à l'expiration. Cependant, les valeurs considérées comme seuils en deçà desquelles on parle de BPCO varient légèrement d'un pays à l'autre ce qui complique les comparaisons et statistiques épidémiologiques mondiales.
Bien que la BPCO soit un véritable enjeu de santé publique[16], au début du XXIe siècle, cette exploration reste loin d'être systématique, entraînant le non-diagnostic d'une proportion importante de patients (ex : 40 à 50 % des cas en Grande-Bretagne[17]).
Des chercheurs espèrent pouvoir bientôt détecter dans l'air expiré des « marqueurs » permettant de mieux diagnostiquer cette maladie et en suivre l'évolution sans avoir à utiliser de techniques invasives (telles que le lavage bronchoalvéolaire) ou des appareils coûteux et sophistiqués comme cela est souvent nécessaire aujourd'hui[18],[19].
Épidémiologie
[modifier | modifier le code]Prévalence : Il est estimé que la bronchopneumopathie chronique obstructive atteint surtout les adultes de plus de 40 ans et sa fréquence augmente avec l'âge.
La BPCO est la quatrième cause de mortalité dans le monde en 2021[20].
Mortalité par BPCO : elle a augmenté de 47 % entre 1979 et 1993 aux États-Unis et a doublé chez la femme entre 1980 et 1995 au Canada. La BPCO est en augmentation constante depuis 20 ans avec plus de 44 millions de malades dans le monde, soit 4 à 10 % de la population adulte[21]. Elle atteindrait près de 10 % de la population adulte des pays occidentaux[22].
L'Organisation Mondiale de la Santé (OMS) estime à 2,7 millions le nombre de morts dus à la BPCO en 2000 dans le monde. Elle prévoit qu'en 2020, cette affection sera la troisième cause de mortalité par maladie dans le monde en raison du tabagisme, notamment celui des femmes.
Épidémiologie en France
[modifier | modifier le code]Au début des années 2000 la BPCO était responsable ou liée à au moins 15 000 décès par an chez les plus de 45 ans[23]. En 1993, 20 % des patients atteints de BPCO étaient des femmes. Aujourd'hui[Quand ?], les femmes constituent 40 à 45 % des malades, probablement car elles sont de plus en plus nombreuses à fumer. Actuellement[Quand ?], 30 % des Françaises fument.
Causes
[modifier | modifier le code]- Tabac : Le tabagisme est la principale cause de la bronchopneumopathie chronique obstructive. À lui seul, il est responsable de 80 % des cas de cette maladie[7]. Le tabagisme passif (l'une des causes fréquentes de pollution de l'air intérieur) augmente également les risques de développer la maladie ;
- Génétique : Une déficience en alpha 1-antitrypsine, d'origine génétique, peut aussi être une cause d'emphysème, mais elle est rare (moins de 1 % des cas) ;
- Asthme : Un asthme (chronique et/ou asthme professionnel) peut évoluer vers une BPCO[24] ;
- Qualité de l'air : La pollution atmosphérique et la pollution de l'air intérieur jouent un rôle certain[25],[26] ; les émanations de foyers chauffant des aliments ou des pièces au bois ou au charbon de bois, voire au charbon dans des installations sommaires, vétustes ou polluantes de l'air intérieur sont des causes de BPCO ; de même pour les particules (minérales ou organiques) inhalées lors des activités de loisir et surtout dans certains environnements professionnels (industries chimique, pétrochimique, pharmaceutique, métiers manipulant des solvants, des acides, fabrications d'encres, travail en milieu/salle stérile – froide, humide et en air conditionné travaux publics et du bâtiment, certaines formes d'artisanat, meulage, sciage, perçage ou ponçage de tous matériaux riches en silice[27] et en particulier du béton[27] ou de substrats contenant des granulats[27] routiers…) ont un rôle néfaste pour les poumons et peuvent causer la maladie ou y contribuer.
En France vers 2005, la fraction de risque attribuable aux expositions professionnelles est évaluée entre 15 et 20 %[28]. Dans ces cas, les patients atteints de BPCO peuvent alors être relativement jeunes.
Le système immunitaire dans la bronchopneumopathie chronique obstructive
[modifier | modifier le code]Les patients atteints de bronchopneumopathie chronique obstructive présentent un nombre accru de macrophages dans leurs voies respiratoires et leur interstitium. Cependant, la fonction de ces macrophages est fortement altérée. Les macrophages alvéolaires dans la bronchopneumopathie chronique obstructive présentent une expression altérée des récepteurs Toll-like qui sont essentiels à la détection des motifs moléculaires associés aux dommages et des motifs moléculaires associés aux pathogènes[29]. De plus, ces macrophages alvéolaires ont des capacités phagocytaires réduites qui peuvent entraîner une inflammation accrue[30]. Des niveaux accrus d'interleukine-8, de facteur de nécrose tumoraleα, dérivé réactif de l'oxygène et de métalloprotéinase matricielle 12 sont produits par les macrophages alvéolaires chez les patients atteints de bronchopneumopathie chronique obstructive[31]. Ces facteurs exacerbent l’inflammation et provoquent des lésions tissulaires. Quant aux macrophages interstitielles, on sait peu de choses sur leur rôle dans la bronchopneumopathie chronique obstructive. Les options thérapeutiques actuelles se concentrent sur la réduction des symptômes de la bronchopneumopathie chronique obstructive plutôt que sur l’inversion de la progression de la maladie. Par conséquent, les chercheurs ont envisagé de cibler les macrophages pulmonaires pour restaurer la fonction pulmonaire. Il a été démontré que le déplacement de la fonction des macrophages vers un phénotype anti-inflammatoire en réduisant le stress oxydatif et en supprimant la libération de médiateurs pro-inflammatoires restaure la fonction phagocytaire des macrophages pulmonaires, améliorant ainsi la pathogenèse de la maladie[32],[33].
Examens complémentaires
[modifier | modifier le code]
- Épreuve fonctionnelle respiratoire ;
- Radiographie pulmonaire pour les épisodes aigus ;
- Gaz du sang artériel ;
- Culture des expectorations (ECBC).
Évolution et complications
[modifier | modifier le code]La plus fréquente parmi les complications de la BPCO est l'insuffisance respiratoire. Il peut également se produire des complications neurologiques, cardiovasculaires ou musculaires. L'insuffisance respiratoire consiste en l'incapacité pour le système respiratoire (poumons et bronches) d'assurer sa fonction d'oxygénation du sang et des organes[34].
La BPCO constitue aussi la seconde cause d'hypertension pulmonaire.
Prise en charge
[modifier | modifier le code]Les fumeurs pratiquant une activité physique d'au moins deux heures par semaine, quelle que soit son intensité, ont un risque réduit de développer une BPCO[35][source insuffisante]. Il faut redévelopper la voie métabolique aérobie des muscles périphériques, contribuer à faire baisser l'hyperventilation, augmenter la tolérance à l'effort.
Gestion au long cours
[modifier | modifier le code]La BPCO étant irréversible, la prise en charge de la maladie a pour principal objectif la restauration ou le maintien de la qualité de vie des patients grâce aux mesures suivantes :
- cessation tabagique ;
- programme d'éducation thérapeutique ;
- réentraînement à l'effort par les activités physiques adaptées (APA) en vue d'améliorer la résistance à l'effort (diminuer la dyspnée dans les activités de la vie quotidienne), de renforcer le fonctionnement du métabolisme aérobie (éviter l'acidose provoquée par l'utilisation préférentielle du métabolisme anaérobie chez ces patients) et d'accompagner vers un mode de vie actif ;
- accompagnement psychologique : les thérapies cognitivo-comportementales présentent un intérêt certain, notamment pour la prise en charge de l'anxiété, d'un éventuel état dépressif, la communication avec les proches…
Prise en charge des épisodes de décompensations aigües
[modifier | modifier le code]- Antibiothérapie. La surinfection est une cause fréquente de décompensation.
- Corticothérapie.
- Bronchodilatateur, généralement distribué par un aérosol-doseur. Bien que la réponse objective à ceux-ci (augmentation du VEMS) soit le plus souvent considérée non significative (soit en dessous de 12-15 % d'augmentation), ils sont fréquemment utilisés en raison du soulagement que les patients disent en ressentir.
- Support ventilatoire mécanique, invasif ou non.
Recommandation de la Société de pneumologie de langue française dans la prise en charge de la BPCO
[modifier | modifier le code]- Stade 1 léger (VEMS/CV < 0,7 et VEMS> 80 % de la théorie) : réduction des facteurs de risques, vaccination anti-grippale, bronchodilatateur de courte durée d'action (Ventoline)[36].
- Stade 2 modéré (VEMS/CV < 0,7 et 50 % < VEMS < 80 % de la théorie) - un ou plusieurs bronchodilatateurs de longue durée d'action tels les béta 2 mimétiques en inhalation[36] : formotérol, fénotérol ou salmétérol) et ou les anticholinergiques en inhalation (ipratropium, tiotropium, aclidinium ou glycopyrronium…
- Stade 3 sévère (VEMS/CV < 0.7 et 30 % < VEMS < 50 % de la théorie) : glucocorticostéroïdes inhalés en association fixe avec un bronchodilatateur si exacerbations répétées malgré un traitement bronchodilateur bien conduit (fluticasone ou budésonide)[36].
- Stade 4 très sévère (VEMS/CV < 0.7 et VEMS < 30 %) : oxygénothérapie de longue durée si insuffisance respiratoire, traitements chirurgicaux[36].
Supplémentation en vitamine D3
[modifier | modifier le code]Chez les patients souffrant de carences en vitamine D3, la supplémentation en vitamine D3 permet de réduire les exacerbations chez les patients atteints de BPCO modérée à très sévère, mais n'a aucun effet chez les patients présentant des taux normaux en vitamine[37]. Chez ceux à faible masse musculaire, une supplémentation sur le long terme (1 an) n'améliore pas les performances physiques, mais permet une légère amélioration non spécifique de la santé de manière générale due à l'augmentation du taux plasmatique de vitamine D3[38].
BPCO et activité physique
[modifier | modifier le code]Idées reçues, jusqu’en 1990 :
- La pratique physique régulière est néfaste car elle entraîne l’essoufflement.
- L’activité physique n’a jamais changé la fonction respiratoire d’un sujet BPCO.
- L’activité physique est donc inutile, difficile à faire accepter et elle est non pertinente.
Les principaux changements :
- il y a eu beaucoup d’études sur l’adaptation des BPCO à l’exercice. On a compris l’interface entre l’exercice physique et la BPCO.
- On sait que la tolérance à l’effort n’est pas seulement liée à la sévérité de la BPCO, calculée avec le VEMS. Celui-ci classe le degré de la pathologie mais pas la tolérance à l’effort.
- Le BODE index est un ensemble de 4 tests pour mieux rendre compte de l’impact de la BPCO dans la vie du sujet.
- Le muscle du BPCO[Quoi ?] est une usine à problème. Toutes les anomalies musculaires ne sont pas liées à une insuffisance de la délivrance en O2.
Aspects juridiques (cas des maladies professionnelles)
[modifier | modifier le code]Dans divers pays (dont en France depuis 1989), cette pathologie est prise en compte dans la gestion des maladies professionnelles. En France, des mesures réglementaires dans le régime général de la sécurité sociale et dans le régime agricole ont été peu à peu prises, qui permettent dans certains contextes et à certaines conditions la réparation de certaines BPCO d’origine professionnelle[39].
Notes et références
[modifier | modifier le code]- « C’est quoi, la MPOC? : L'Association Pulmonaire », sur poumon.ca via Wikiwix (consulté le ).
- https://www.who.int/fr/news-room/fact-sheets/detail/chronic-obstructive-pulmonary-disease-(copd)
- Rafenberg C, Dixsaut G & Annesi-Maesano I (2015) Évaluation à minima du coût de la pollution atmosphérique pour le système de soin français. Environnement, Risques & Santé, 14(2), 135-150.
- Waldmann V, Bougouin W, Karam N, Albuisson J, Cariou A, Jouven X & Marijon E (2017). Mort subite de l’adulte: une meilleure compréhension pour une meilleure prévention. Journal Européen des Urgences et de Réanimation, 29(4), 327-336.|résumé
- « Bronchopneumopathie chronique obstructive (BPCO) ⋅ Inserm, La science pour la santé », sur Inserm (consulté le ).
- (en) Ben Knox-Brown, James Potts, Valentina Quintero Santofimio et Cosetta Minelli, « Isolated small airways obstruction predicts future chronic airflow obstruction: a multinational longitudinal study », BMJ Open Respiratory Research, vol. 10, no 1, , e002056 (ISSN 2052-4439, PMID 37989490, PMCID PMC10660204, DOI 10.1136/bmjresp-2023-002056, lire en ligne, consulté le )
- Société de Pneumologie de Langue Française, BPCO, [lire en ligne]
- Comité National contre les maladies respiratoires, BPCO, [lire en ligne]
- Garnier & Delamare, Dictionnaire des termes de médecine, Maloine, Paris, 2002, (ISBN 2-224-02737-0)
- Stéphane Gabbio, Isabelle Moncada, Claudette Lefaye, « La BPCO (bronchopneumopathie chronique obstructive), une épidémie silencieuse », CQFD, La 1re, (lire en ligne [audio])
- « Explosion des maladies respiratoires : détecter les premiers signes ! », 36.9°, Radio télévision suisse, (lire en ligne [vidéo]) « Bronchopneumopathie chronique obstructive, ou BPCO : c'est une maladie grave et invalidante, qui détruit le souffle inexorablement. Elle touche 400 000 personnes en Suisse, et, selon l'OMS, elle deviendra bientôt la 3e cause de mortalité dans le monde. »
- (en) Peter Burney, Jaymini Patel, Cosetta Minelli et Louisa Gnatiuc, « Prevalence and Population-Attributable Risk for Chronic Airflow Obstruction in a Large Multinational Study », American Journal of Respiratory and Critical Care Medicine, vol. 203, no 11, , p. 1353–1365 (ISSN 1073-449X et 1535-4970, PMID 33171069, PMCID PMC8456536, DOI 10.1164/rccm.202005-1990OC, lire en ligne, consulté le )
- Desqueyroux H& Momas I (2001) Impact à court terme de la pollution atmosphérique urbaine sur l'insuffisance respiratoire par bronchopneumopathie chronique obstructive (BPCO). Synthèse des études, en France en 2001
- Amiot N, Tillon J, Viacroze C, Aouine H & Muir J.F (2012) Répercussions des fluctuations de la pollution atmosphérique chez les patients atteints de bronchopneumopathie chronique obstructive. Revue Française d'Allergologie, 52(1), 36-41.
- Soumagne T, Caillaud D, Degano B & Dalphin J.C (2017) BPCO professionnelles et BPCO post-tabagique: similarités et différences. Revue des Maladies Respiratoires|résumé.
- Fuhrman, C., & Delmas, M. C. (2010). Épidémiologie descriptive de la bronchopneumopathie chronique obstructive (BPCO) en France. Revue des Maladies Respiratoires, 27(2), 160-168.
- (en) G Devereux, « ABC of chronic obstructive pulmonary disease: Definition, epidemiology, and risk factors » BMJ 2006;332:1142-1144.
- (en) I. Horvath, J. Hunt, P.J. Barnes, K. Alving, A. Antczak, E. Baraldi, et al. (2005) Exhaled breath condensate: methodological recommendations and unresolved questions ; European Respiratory Journal, 26 (3) (Sept), pp. 523-548
- (en) Larsson P, Mirgorodskaya E, Samuelsson L, Bake B, Almstrand A.C, Bredberg A & Olin A.C (2012) Surfactant protein A and albumin in particles in exhaled air. Respiratory medicine, 106(2), 197-204.
- « Bronchopneumopathie chronique obstructive (BPCO) », sur www.who.int (consulté le )
- Ministère de la Santé, juillet 2005.
- (en) Buist AS, McBurnie MN, Vollmer WM et Als, International variation in the prevalence of COPD (The BOLD Study): a population-based prevalence study, Lancet, 2007 ; 370 :741-750
- Fuhrman C, Delmas MC, Nicolau J, Jougla E, « Mortalité liée à la BPCO en France métropolitaine, 1979-2003 », Bulletin Epidémiologique Hebdomadaire, nos 27-28, , p. 242-5 (lire en ligne)
- Jouneau S (2006) Facteurs de risque de la BPCO : au-delà de la cigarette. Revue des Maladies Respiratoires, 23(5), 20-24.
- Allain Y-M, Roche N & Huchon G (2011) Pollution atmosphérique, facteur de risque des BPCO ? Revue française d'allergologie, Vol. 51, no 1, janvier 2011, p. 41-55 (résumé)
- Y.-M. Allain, N. Roche, G. Huchon (2010), Pollution atmosphérique, facteur de risque des BPCO ? Revue des Maladies Respiratoires, Volume 27, Issue 4, April 2010, p. 349-363 (résumé)
- Dangers, expositions et risques relatifs à la silice cristalline Rapport d’expertise collective – Saisine « no 2015-SA-0236 — Silice cristalline » | mars.
- Benard E, Detournay B, Neukirch F, Pribil C & El Hasnaoui A (2005). Prévalence de la Bronchopneumopathie Chronique Obstructive (BPCO) : estimation pour la France. La Lettre du pneumologue, 8, 158-63.
- (en) Charles S Berenson, Ragina L Kruzel, Ellana Eberhardt et Ree Dolnick, « Impaired innate immune alveolar macrophage response and the predilection for COPD exacerbations », Thorax, vol. 69, no 9, , p. 811–818 (ISSN 0040-6376 et 1468-3296, DOI 10.1136/thoraxjnl-2013-203669, lire en ligne, consulté le )
- (en) Kylie B.R. Belchamber, Richa Singh, Craig M. Batista et Moira K. Whyte, « Defective bacterial phagocytosis is associated with dysfunctional mitochondria in COPD macrophages », European Respiratory Journal, vol. 54, no 4, , p. 1802244 (ISSN 0903-1936 et 1399-3003, DOI 10.1183/13993003.02244-2018, lire en ligne, consulté le )
- (en) Adam J Byrne, Sara A Mathie, Lisa G Gregory et Clare M Lloyd, « Pulmonary macrophages: key players in the innate defence of the airways », Thorax, vol. 70, no 12, , p. 1189–1196 (ISSN 0040-6376 et 1468-3296, DOI 10.1136/thoraxjnl-2015-207020, lire en ligne, consulté le )
- (en) Changsuk Moon, Ye-Ji Lee, Hyun-Jeong Park et Young H. Chong, « N-Acetylcysteine Inhibits RhoA and Promotes Apoptotic Cell Clearance during Intense Lung Inflammation », American Journal of Respiratory and Critical Care Medicine, vol. 181, no 4, , p. 374–387 (ISSN 1073-449X et 1535-4970, DOI 10.1164/rccm.200907-1061OC, lire en ligne, consulté le )
- (en) Kentaro Akata et Stephan F. van Eeden, « Lung Macrophage Functional Properties in Chronic Obstructive Pulmonary Disease », International Journal of Molecular Sciences, vol. 21, no 3, , p. 853 (ISSN 1422-0067, PMID 32013028, PMCID PMC7037150, DOI 10.3390/ijms21030853, lire en ligne, consulté le )
- Muir J.-F. ; Bronchopneumopathies chroniques obstructives et leurs complications : épidémiologie, étiologie, physiopathologie, diagnostic, évolution, prévention, traitement, posologie de l'oxygénothérapie; La Revue du praticien; 1995, vol. 45, no 16, p. 2085-2097
- Garcia-Aymericg et coll., 2007
- Promoteur : Société de Pneumologie de Langue Française, « Recommandations pour la pratique clinique : Prise en charge de la BPCO [The French-speaking Society of Pneumology recommendations on the management of COPD] », Rev Mal Respir, vol. 27, no Suppl 1, , S1-76, I-XXXI. (PMID 20931674, lire en ligne [PDF])
- (en) Adrian R, Martineau, Wai Yee James, Richard L Hooper, Neil C Barnes, David A Jolliffe, Claire L Greiller, Kamrul Islam, David McLaughlin, Angshu Bhowmik, Peter M Timms, Raj K Rajakulasingam, Marion Rowe, Timothy R Venton, Aklak B Choudhury, David E Simcock, Mark Wilks, Amarjeet Degun, Zia Sadique, William R Monteiro, Christopher J Corrigan, Catherine M Hawrylowicz, Christopher J Griffiths, « Vitamin D3 supplementation in patients with chronic obstructive pulmonary disease (ViDiCO): a multicentre, double-blind, randomised controlled trial », The Lancet Respiratory Medecine, vol. 3, , p. 120 (DOI 10.1016/S2213-2600(14)70255-3)
- (en) Martijn van Beersa, Maureen P.M.H, Rutten-van Mölkenb, Coby van de Boola, Melinde Bolandb, Stef P.J. Kremersc, Frits M.E. Franssena, Ardy van Helvoorta, Harry R. Goskera, Emiel F. Woutersa, Annemie M.W.J. Schols, « Clinical outcome and cost-effectiveness of a 1-year nutritional intervention programme in COPD patients with low muscle mass: The randomized controlled NUTRAIN trial », Clinical Nutrition, (DOI 10.1016/j.clnu.2019.03.001)
- Andujar P. & Dalphin J. C. (2016), Bronchopneumopathies chroniques obstructives professionnelles. Aspects médicolégaux, conduite à tenir en pratique, revue des Maladies Respiratoires, 33(2), pp. 91-101|résumé
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- P. Andujar et J. -C. Dalphin, « Bronchopneumopathies chroniques obstructives professionnelles. Aspects médicolégaux, conduite à tenir en pratique », Revue des Maladies Respiratoires, vol. 33, no 2, , p. 91–101 (ISSN 0761-8425, DOI 10.1016/j.rmr.2015.05.009, lire en ligne, consulté le )
- A. Chaouat et N. Roche, « Bronchopneumopathie chronique obstructive », Revue des Maladies Respiratoires, vol. 21, no 4, Part 1, , p. 845–848 (ISSN 0761-8425, DOI 10.1016/S0761-8425(04)71431-X, lire en ligne, consulté le )
- M. Dres, « Bronchopneumopathie chronique obstructive », Revue des Maladies Respiratoires Actualités, rapport de la mission ERS 2012 : Vienne, 1-5 septembre 2012, vol. 4, no 7, , p. 697–702 (ISSN 1877-1203, DOI 10.1016/S1877-1203(12)70337-3, lire en ligne, consulté le )
- C. Fuhrman et M. -C. Delmas, « Épidémiologie descriptive de la bronchopneumopathie chronique obstructive (BPCO) en France », Revue des Maladies Respiratoires, vol. 27, no 2, , p. 160–168 (ISSN 0761-8425, DOI 10.1016/j.rmr.2009.08.003, lire en ligne, consulté le )
- Jébrak G (2008) Bronchopneumopathie chronique obstructive.
- S. Jouneau et C. Raherison, « Bronchopneumopathie chronique obstructive », Revue des Maladies Respiratoires Actualités, rapport de la mission ERS 2009, vol. 2, no 1, , p. 15–20 (ISSN 1877-1203, DOI 10.1016/S1877-1203(10)70019-7, lire en ligne, consulté le )
- D MISPELAERE, J. C. GLERANT, M. AUDEBERT et A. REMOND, « Embolie pulmonaire et formes sibilantes des décompensations de bronchopneumopathie chronique obstructive », Embolie pulmonaire et formes sibilantes des décompensations de bronchopneumopathie chronique obstructive, vol. 19, no 4, , p. 415–423 (ISSN 0761-8425, lire en ligne, consulté le )
- C. Renkin, Jean-Louis Corhay et Renaud Louis, « La place de l'analyse du condensat de l'air exhalé dans les maladies pulmonaires obstructives. », Revue Médicale de Liège, vol. 63, no 4, (ISSN 0370-629X, PMID 18575074, hdl 2268/5372, lire en ligne, consulté le )
- Thomas SIMILOWSKI, Isabelle BOUCO, Daniel PIPERNO et Gérard HUCHON, « Bronchopneumopathie chronique obstructive en France : le point de vue des patients. Résultats d'une enquête internationale (confronting COPDd) », Bronchopneumopathie chronique obstructive en France : le point de vue des patients. Résultats d'une enquête internationale (confronting COPDd), vol. 32, no 30, , p. 1403–1409 (ISSN 0755-4982, lire en ligne, consulté le )
- I. Tillie-Leblond et F. Masure, « « EXACO » : suivi sur 4 ans des exacerbations d’une cohorte de patients atteints de bronchopneumopathie chronique obstructive », Revue des Maladies Respiratoires, vol. 23, no 4, Part 1, , p. 377–384 (ISSN 0761-8425, DOI 10.1016/S0761-8425(06)71607-2, lire en ligne, consulté le )
Article connexe
[modifier | modifier le code]Liens externes
[modifier | modifier le code]
- Ressources relatives à la santé :
- Notice dans un dictionnaire ou une encyclopédie généraliste :
- (en) GOLD (Global Initiative for Chronic Obstructive Lung Disease)
- Dossier d'information Bronchopneumopathie chronique obstructive sur le site de l'Inserm
- Tout savoir sur la BPCO sur le site www.lesouffle.org