Nitramido
Aspekto
| Nitrilamido | ||
| Kemia formulo | ||
 | ||
Nitramido | ||
 | ||
| Alternativa(j) nomo(j) | ||
| ||
| CAS-numerm-kodo | 7782-94-7 | |
| ChemSpider kodo | 22941 | |
| PubChem-kodo | 24534 | |
| Fizikaj proprecoj | ||
| Aspekto | senkolora aŭ blanka solidaĵo | |
| Molmaso | 62,028g mol−1 | |
| Denseco | 1,378 g/cm−3[1][2] | |
| Fandpunkto | 72-75°C [3] | |
| Acideco (pKa) | 1.429 [4] | |
| Solvebleco | Akvo:solvebla | |
| Mortiga dozo (LD50) | 410 mg/kg (buŝe) [5] | |
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P264+265, P271, P280, P302+352, P304+340, P305+351+338, P319, P321, P332+317, P337+317, P362+364, P403+233, P405, P501 | |
(25 °C kaj 100 kPa) | ||
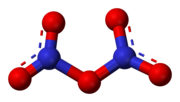
Nitramido aŭ nitrilamido estas neorganika kombinaĵo de nitrogeno kaj la sola neorganika amido. Ĝi estas amino-amida substanco, senkolora solidaĵo, uzata kiel eksplodaĵo, kies derivaĵoj estas RDX kaj HMX (vidu reakciojn 6 kaj 7). Nitramido estas izomero de la hiponitroza acido. Ĝia molekulo esence estas amina grupo ligita al nitra grupo, ne planara en la gasfazo sed planara en la kristalfazo. Nitramido devas storiĝi ekskluzive en vitraj aŭ platinaj ujoj ĉar ĝi atakas latunon kaj metalaĵoj. Nitramido estis unuafoje sintezita de Johannes Thiele (1865-1918) kaj Arthur Lachman (1873-1957)[6] en 1896.[7] En alkala akva solvaĵo, nitramido malkomponiĝas en akvon kaj dunitrogenan oksidon (vidu reakcion 5).
| Bonvolu ne konfuzi... | |
 |
 |
| Hiponitroza acido estas izomero de la nitramido | |
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Preparado de nitramido per traktado de sulfata acido kun kalia nitrokarbamato:[8]
Reakcio 2
[redakti | redakti fonton]- Preparado de nitramido per malkomponado de la nitrokarbamata acido:
Reakcio 3
[redakti | redakti fonton]- Preparado de nitramido per traktado de nitrata acido kun natria sulfamato:
Reakcio 4
[redakti | redakti fonton]- Preparado de nitramido per traktado de amoniako kun dunitrogena pentoksido:
Reakcio 5
[redakti | redakti fonton]- Malkomponado de la nitramido: Per varmigo, nitramido malkomponiĝas en dunitrogena oksigeno kaj akvo:[9]
Reakcio 6
[redakti | redakti fonton]- RDX (trinitramido, mallongigo por Rojala eksplodaĵo por Malkonstruado) estas trimero de la nitramido. Ĝi estas blanka solidaĵo pli detrua ol TNT. RDX estis uzata dum la 2-a Mondmilito kaj ankaŭ restas en la militaj aplikoj. RDX prepariĝas per nitrolizo de la heksametilenotetramino:
Reakcio 7
[redakti | redakti fonton]- HMX (aŭ tetranitramido, kies signifo estas Alta Fandopunkto Eksplodaĵo), kune kun RDX, estas alta pezmolekula eksplodaĵo kaj unu el la plej potencaj kemiaĵoj kun detrupovoj.