Uhlík
| Uhlík | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Periodická tabulka ↓ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Diamant a grafit | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Uhlík, C, 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cizojazyčné názvy | lat. carbonium, carboneum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, perioda, blok | 14. skupina, 2. perioda, blok p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Nekovy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v zemské kůře | 200 až 800 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v mořské vodě | 28 mg/l | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | Černá látka nebo bezbarvá, průhledná látka | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Registrační číslo CAS | 7440-44-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 12,0107 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr | 70 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 73±4 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsův poloměr | 170 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronová konfigurace | [He] 2s2 2p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační čísla | +IV, +II, +I, 0, −II, −IV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita (Paulingova stupnice) | 2,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizační energie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| První | 1086,5 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Druhá | 2352,6 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Třetí | 4620,5 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Látkové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografická soustava | Šesterečná (grafit) Krychlová (diamant) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 5,29×10−6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 2270 kg/m3 (grafit) 3513 kg/m3 (diamant) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenství | Pevné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tvrdost | Grafit: 1–2 Diamant: 10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | Diamant: 18350 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | Grafit: 119–165 W·m−1·K−1 Diamant: 900–2300 W⋅m−1⋅K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota tání | 3642 °C (3 915,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 4027 °C (4 300,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo tání | 117 KJ/mol (grafit) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná tepelná kapacita | 8,517 Jmol−1K−1 (grafit); 6,155 Jmol−1K−1 (diamant) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektromagnetické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrická vodivost | Grafit: ~ 104 S·m−1 Diamant: ~ 10−3 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrný elektrický odpor | Grafit: ~ 10−4 Ωm Diamant: ~ 103 Ωm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetické chování | Diamagnetický (grafit i diamant) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bezpečnost | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [1] Varování[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Uhlík (chemická značka C, latinsky carbonium nebo carboneum) je chemický prvek, tvořící základní stavební kámen všech organických sloučenin a tím i všech živých organismů na této planetě. Sloučeniny uhlíku jsou jedním ze základů světové energetiky, kde především fosilní paliva jako zemní plyn a uhlí slouží jako energetický zdroj pro výrobu elektřiny a vytápění, produkty zpracování ropy jsou nezbytné pro pohon spalovacích motorů a tak silniční a železniční dopravu. Výrobky chemického průmyslu na bázi uhlíku jsou součástí našeho každodenního života, ať jde o plastické hmoty, umělá vlákna, nátěrové hmoty, léčiva a mnoho dalších. V současné době bylo popsáno přibližně 10 milionů organických sloučenin.[2][3]
Formy uhlíku
[editovat | editovat zdroj]Elementární uhlík
[editovat | editovat zdroj]Uhlík je typický nekovový chemický prvek, který se v elementárním stavu jako minerál vyskytuje v přírodě ve dvou základních alotropních modifikacích a v posledních přibližně 30 letech byly objeveny v přírodě nebo laboratorně vytvořeny modifikace další:

Grafit (tuha) je nejčastější přírodní modifikace uhlíku, jejíž struktura se skládá z vrstev tzv. grafenu, které jsou tvořeny uhlíky navázanými do šestiúhelníků. Na každý uhlík jsou kovalentně vázány další tři uhlíky (hybridizace sp2). Tvoří se zde rozsáhlý systém delokalizovaných elektronů (π-systém). Jednotlivé vrstvy spolu drží pouze pomocí slabých interakcí, tzv. van der Waalsových sil. Této vlastnosti se využívá např. při výrobě tužek, kde mletá tuha tvoří základní složku tyčinky určené pro psaní a kreslení. Grafit vede elektrický proud.

Diamant je tvořen uhlíkem krystalizujícím v soustavě krychlové a je nejtvrdším[pozn. 1][pozn. 2] a velmi cenným přírodním nerostem. Na každý uhlík jsou kovalentně vázány další čtyři uhlíky (hybridizace sp3). Hmotnost diamantů se udává v karátech, největším doposud nalezeným diamantem byl Cullinan, který v surovém stavu při nálezu v JAR dosáhl váhy 3 106 karátů (621,2 gramů). Diamanty se používají pro svou tvrdost a výbornou tepelnou vodivost (až 2300 W·m−1·K−1 při pokojové teplotě a normálním izotopickém složení) v nejrůznějších řezných a vrtných nástrojích. Pro vysokou cenu bývají diamanty vyráběny synteticky.
Diafit je nově používané označení pro modifikaci uhlíku v přechodových nanostrukturách mezi mřížkou diamantu (případně lonsdaleitu) a vhodně orientovanými vrstvami grafitu. Nacházejí se v přírodních materiálech i uměle vytvořených uhlíkových kompozitech a vznikají například při dopadech meteoritů nebo v tlakově-teplotních rázových vlnách při laboratorním ozařování grafitu vysokoenergetickými laserovými pulsy. Přechody mezi doménami s hybridizací sp2 (tvořenými vrstvami grafenu) a sp3 umožňují kombinaci vyhledávaných vlastností – vysoké tvrdosti současně s vysokou lomovou houževnatostí a tažností.[8][9][10]

Lonsdaleit, též zvaný „šesterečný diamant“, je velmi řídce se vyskytující přírodní alotropní modifikací uhlíku. Jeho krystalová struktura je tvořena podobně jako u diamantu atomy uhlíku vázanými jednoduchými kovalentními vazbami se čtyřmi sousedy, krystalová soustava je však šesterečná. Původ přírodního lonsdaleitu je vysvětlován přeměnou grafitu při dopadech meteoritů.[11][12][pozn. 3]
Fcc-uhlík s plošně centrovanými elementárními buňkami (odtud název z angl. face centered cell), někdy považovaný za variantu diamantu, jindy za novou základní alotropní modifikaci uhlíku, se vyznačuje neobvyklým typem vodivosti, kvůli které je řazen do samostatné třídy kvazivalenčních pevných látek. Povaha chemických vazeb předpokládá zápornou elektronovou afinitu a umožňuje očekávat vysokou polarizovatelnost a velmi nízkou tepelnou vodivost. Na potvrzení jeho existence (v r. 2024) se podíleli vědci z ČVUT.[17][18][19]
Superdiamant, přesněji uhlík fáze BC8, je předpovězená kubická fáze s prostorově centrovanými elementárními buňkami, která je podobná diamantu, ale má ještě o 30 % vyšší tuhost. Její výskyt je možný jen v exotických podmínkách – studie předpokládá vznik jejích krystalů z podchlazené uhlíkové taveniny při teplotě cca 6000 K a tlacích nad 1200 GPa – čemuž v přírodě odpovídají jádra na uhlík bohatých exoplanet.[20][21]
Chaoit (čaoit), též zvaný „bílý uhlík“, je velmi řídce se vyskytující přírodní alotropní modifikace uhlíku, objevená r. 1968.[22] Jeho základní strukturní jednotkou jsou šestihrany tvořené 6 paralelními karbynovými řetězci, zapsatelnými vzorcem −(C≡C)n−.[23] Tento nerost krystalizuje v šesterečné soustavě. Původ je jako u lonsdaleitu vysvětlován přeměnou grafitu při dopadech meteoritů, v jejichž dopadových kráterech se nachází.

Grafen je forma uhlíku, kterou tvoří jedna či několik málo vrstev rovinné sítě vzájemně propojených atomů uhlíku uspořádaných do tvaru šestiúhelníků (hybridizace sp2). Jedná se o vlastně strukturní součást grafitu, která si vzhledem ke zvláštním fyzikálním vlastnostem, výborné tepelné vodivosti (přes 4000 W·m−1·K−1 u izotopicky čištěného grafenu[24]) a využitelností pro mnohé elektronické a optické aplikace zasloužila vlastní název i Nobelovu cenu za fyziku v r. 2010 pro své objevitele. Předpokládá se široké uplatnění v nových generacích elektroniky, založených na spintronice.[25] Dvouvrstvý grafen se vzájemně pootočenými vrstvami se vyznačuje exotickými a pro aplikace zajímavými vlastnostmi, které se výrazně mění s úhlem natočení (např. supravodivý stav pro tzv. magický úhel).[26][27][28]

Grafyn je společné označení pro formy uhlíku, kterou tvoří jako u grafenu jedna či několik málo vrstev rovinné sítě vzájemně propojených atomů uhlíku, které však již vzhledem k vloženým lineárním úsekům −C≡C− (hybridizace sp) nejsou uspořádány do tvaru pravidelných šestiúhelníků. Přesto si zachovávají mnohé zvláštní fyzikální vlastnosti. Mohou být takto vytvořeny grafyny různé symetrie, včetně pravoúhelníkové.[29][30] Úspěšná syntéza grafynu s nejhustší strukturou, tzv. γ-grafynu, byla publikována v r. 2022.[31][32] Formy grafynu s větší porézností (díky většímu počtu vložených úseků −C≡C−), např. tzv. grafdiyn, by mohly najít využití jako anody nabíjitelných baterií.[33][34]
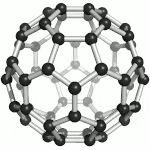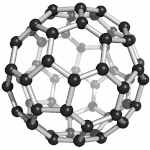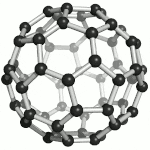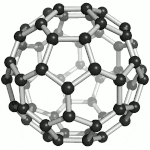
Fullereny označují sférické (též elipsoidální či podobného tvaru) molekuly z jedné prostorově uzavřené vrstvy grafenu, tedy sítě uhlíkových atomů uspořádaných do šestiúhelníků, doplněných kvůli prostorovému uzavření dvanácti pětiúhelníky. Tyto molekuly jsou mimořádně odolné vůči vnějším fyzikálním vlivům. Zatím nejstabilnější známý fulleren je molekula, obsahující 60 uhlíkových atomů. Fullereny se uměle připravují pyrolýzou organických sloučenin laserem. Výskyt přírodních fullerenů ve vesmíru byl prokázán v r. 2010 Spitzerovým teleskopem.[35] Za objev a studium vlastností fullerenů byla v roce 1996 udělena Nobelova cena Robertu F. Curlovi a Richardu E. Smalleymu a Haroldu W. Krotoovi.

Fullerit se nazývá krystalová struktura tvořená fullereny C60. Ty lze uspořádat více způsoby – fullerit krystalizuje v krychlové soustavě (nad teplotou ~250 K v plošně centrované mřížce, pod teplotou ~220 K v prosté mřížce);[36] uvádí se i soustava čtverečná[37]. Výskyt přírodního fulleritu ve vesmíru byl prokázán v r. 2012 Spitzerovým teleskopem.[35] Doposud nebyl uznán (v žádné ze svých krystalografických podob) Mezinárodní mineralogickou asociací jako minerál.
Podobně jako je grafen jednovrstvá či několikavrstvá část struktury grafitu se svébytnými vlastnostmi, jednovrstvá resp. několikavrstvá část fulleritu se nazývá grafulleren resp. grafullerit. Jednotky tvořené fullerenem C60 jsou v těchto alotropních modifikacích kovalentně vázány do rovinné struktury a jednotlivé vrstvy pak slabě vázané van der Waalsovými silami. Syntéza byla publikována v r. 2023. Vysoká tepelná vodivost a specifické optoelektrické vlastnosti slibují využitelnost těchto materiálů v technologických aplikacích.[38][39][40]
Vzhledem ke slabé molekulové vazbě fullerenových jednotek fullerit nevyniká vysokou tvrdostí, stlačením však lze přetvořit do kompozitu, ve kterém se jednotlivé fulereny kovalentně propojí do amorfní struktury a výsledný materiál získá vysokou tvrdost. Příkladem je tisnumit, vytvořený v r. 1998, schopný rýt diamant.[41]
Podobnou objevenou amorfní modifikací jsou tzv. uspořádané amorfní uhlíkové klastry (OACC – z anglického ordered amorphous carbon clusters). Vytváří se z fullerenů C60 (propojených xylenovými molekulami), jejichž struktura je působením vysokého tlaku desítek GPa zborcena do kompaktní a velmi tvrdé amorfní látky, taktéž schopné rýt i diamant. Protože se vytváří při pokojové teplotě, mohla by v průmyslovém využití konkurovat syntetickým diamantům, pro jejichž výrobu jsou nutné teploty kolem 1500 °C.[42]
Fullerenovou strukturu zborcenou do amorfní sklovité formy má pravděpodobně také tzv. skelný či sklovitý uhlík, zvaný též skelný grafit, vyrobený v 50. letech 20. století v laboratořích britské The Carborundum Company.[43] Je kompaktní a neprostupný pro plyny a tekutiny. Kombinuje sklo-keramické charakteristiky (vysoká tvrdost, vysokoteplotní stálost i chemická odolnost) s vlastnostmi grafitu (dobrá elektrická a tepelná vodivost, nízké tření). Od konce 60. let 20. století se vyrábí také v pěnové formě s velmi nízkou hustotou, pak je označován zkratkou RCV (z angl. reticulated vitreous carbon). V r. 2021 byla zahřátím a stlačním fullerenů připravena další sklovitá modifikace uhlíku, kombinující ve struktuře vazby atomů s hybridizací sp2 a sp3 – diamantové sklo. Vyznačuje se vysokou pevností (odolá tlaku 102 GPa), modulem pružnosti 1,2 GPa a tepelnou vodivostí 26 W m−1 K−1, nejvyšší ze všech známých amorfních materiálů.[44][45] Další nová forma vytvořená v r. 2017, tzv. stlačovaný skelný uhlík, má strukturu odlišnou: Je tvořen grafenovými vrstvami (s hybridizací sp2) nejen vrstevnatě uspořádanými jako v grafitu, ale navíc lokálně propojenými mikrostrukturami s diamantovou či lonsdaleitovou mříží (s hybridizací sp3). Vyznačuje se exotickými vlastnostmi - je nejen velmi lehký, ale také pevný a současně ohebný a dobře vede elektrický proud.[46][47]

Uhlíkové nanotrubice jsou uměle vyrobené mikroskopické trubičky složené z válcově svinuté vrstvy grafenu o průměru pouhých několika (1–100) nanometrů. Perspektiva jejich využití se nabízí např. při výrobě velmi pevných a zároveň lehkých kompozitních materiálů a tkanin, v elektronice při výrobě mimořádně malých tranzistorů, jako ideálního materiálu pro uchovávání čistého vodíku pro palivové články a mnohé další.
Uhlíková nanopěna je řídká prostorová síť tvořená plošnými klastry uhlíkových atomů o velikosti několika nanometrů, které jsou podobné grafenu, ale protože atomy jsou uspořádány vedle šestiúhelníků také do sedmiúhelníků, je výsledná křivost plochy klastru na rozdíl od fullerenů záporná (hyperbolická).[48] Tato modifikace byla vytvořena v r. 1997. Vyznačuje se pozoruhodnými fyzikálními vlastnostmi – vedle elektrické vodivosti je silně paramagnetická.[49]
Teoreticky předpovězené uhlíkové modifikace tvořené grafenovými plochami zakřivenými do dokonale symetrických struktur se zápornou křivostí (a z toho vyplývajícími exotickými vlastnostmi), tzv. schwarzity[50][51], byly dosud vytvořeny jen jako povrchové struktury na zeolitové matrici.[52][53]
Zborcením fullerenových struktur a jejich kovalentním provázáním mohou vzniknout alotropní modifikace, které sice nemají ideální symetrickou strukturu jako fullereny, grafeny, uhlíkové nanotrubice či schwarzity, přesto mohou vykazovat určitou dlouhodosahovou symetrii. Příkladem je tzv. LOPC (z angl. long-range ordered porous carbon, tedy pórovitý uhlík s uspořádáním dlouhého dosahu), jehož vytvoření bylo publikováno v roce 2023.[54][pozn. 4]
Uhlík M (též M-uhlík) je umělá supertvrdá alotropní modifikace uhlíku vyskytující se při vysokých tlacích (nad 13,4 GPa při standardní teplotě). Byla vytvořena v roce 2009 stlačením grafitové struktury[56] a potvrzená v roce 2012.[57][58] Její struktura je jednoklonná. Tvrdostí je srovnatelná s diamantem.[58]
Uhlík Q (též Q-uhlík) je umělá alotropní modifikace tvořená krystalickou nanovrstvou kovalentně vázaných atomů uhlíku s hybridizací sp3 (20%–50%) a sp2, která obsahuje monokrystalické nanočástice diamantu. Objev byl zveřejněn v roce 2015. Vytváří se na substrátu jiné látky (safír, sklo, plast) z vrstvy amorfního uhlíku jejím prudkým zahřátím laserovými pulsy na několik tisíc stupňů Celsia a následným prudkým ochlazením. Výsledkem jsou exotické vlastnosti, které se liší podle substrátu, tloušťky vrstvy a rychlosti ochlazení – může být feromagnetický, může při zahřátí světélkovat, může vykazovat tvrdost větší než diamant.[59][60][61][62]

Jako karbyn (někdy karbin podle ruského originálu, též „LAC“ z anglického linear acetylenic carbon) se označuje forma tvořená lineárními molekulami polymerního uhlíku, zapsatelnými vzorcem −(C≡C)n−.[22] Uhlíkové atomy s hybridizací sp jsou kovalentně vázány s dvěma sousedními atomy. V přírodě se vyskytuje jako strukturní jednotka chaoitu.[22][23] Chemicky aktivní konce molekul se mohou vzájemně spojovat a vytvářet uzavřené molekulární řetězce (cyklický karbyn C18 se podařilo prokazatelně připravit v roce 2019[63][64]). Karbyn se chová jako polovodič. Zájmem nanotechnologů jsou i jeho mechanické vlastnosti[65][66][67] – při dobrém rovnoběžném uspořádání makromolekul se v daném směru vyznačuje modulem pružnosti 40krát vyšším než má diamant; protože pevností v tahu dvojnásobně převyšuje i uhlíkové nanotrubice, jedná se o vůbec nejpevnější známý materiál.[68] Karbyn byl připraven v 60. letech 20. století v Ústavu organických sloučenin Akademie věd SSSR;[69] ještě na začátku 21. století však byla jeho existence jako alotropní modifikace uhlíku zpochybňována.[70] Je totiž vysoce nestabilní; delší řetězce (přes 6000 atomů) se podařilo syntetizovat a udržet až v r. 2016 s využitím jiné uhlíkové modifikace – uvnitř dvoustěnných uhlíkových nanotrubic.[71][72] Byla připravena i forma tvořená řetězci =(C=C)n=, tedy se strukturou kumulenu, tzv. β-karbyn (struktura střídající jednoduché a trojné vazby je proto někdy zvána α-karbyn).[73][74]

Amorfní uhlík je forma uhlíku bez pravidelné krystalové struktury. Obsahuje atomy uhlíku jak s hybridizací sp2 (vázaný s třemi sousedními atomy), tak i sp3 (vázaný s čtyřmi sousedními atomy) v různém poměru, přičemž může obsahovat jak velké vakance, tak i nanokrystaly grafitu nebo diamantu v amorfní uhlíkové matrici. Z výše uvedených speciálních modifikací k němu patří všechny formy s kompozitní, sklovitou a pěnovou strukturou. Z běžné praxe je znám jeho výskyt jako sazí, vytvářených při nedokonalém spalování v komínech či výfucích. Pro praktické využití (zejména v chemii a lékařství) je amorfní uhlík připravován jako tzv. aktivní uhlí, které má díky pórovité struktuře vysokou adsorpční schopnost.
Anorganické sloučeniny
[editovat | editovat zdroj]V anorganických chemických sloučeninách se uhlík vyskytuje v mocenství +2, +4 a −1.
Z oxidů je důležitý především oxid uhličitý CO2, který se podílí na vytváření rostlinných tkání v procesu zvaném fotosyntéza a současně se vrací do atmosféry pří dýchání živých organizmů a spalování fosilních paliv.
Ve vodě se CO2 rozpouští za vzniku oxoniového iontu H3O+ a hydrogenuhličitanového iontu HCO3−, což je někdy chybně[zdroj?!] označováno jako kyselina uhličitá. Známy jsou především soli. Většina z nich je ve vodě nerozpustná, rozpustné jsou jen uhličitany alkalických kovů a amoniaku. Uhličitany se řadí též i mezi nerosty, některé jsou uvedeny v následující tabulce.
| Název nerostu | Chemický název | Vzorec |
| Kalcit, Aragonit | Uhličitan vápenatý | CaCO3 |
| Magnezit | Uhličitan hořečnatý | MgCO3 |
| Azurit | Dihydroxid diuhličitan triměďnatý | Cu3(CO3)2(OH)2 |
| Malachit | Dihydroxid uhličitan diměďnatý | Cu2CO3(OH)2 |
| Siderit | Uhličitan železnatý | FeCO3 |
| Dolomit | Uhličitan hořečnato-vápenatý | MgCa(CO3)2 |
| Smithsonit | Uhličitan zinečnatý | ZnCO3 |
| Trona | Hydrogenuhličitan uhličitan trisodný | Na3(CO3)(HCO3) |
Oxid uhlíku s valencí +2, oxid uhelnatý CO je značně toxický plyn, který blokuje krevní barvivo hemoglobin a znemožňuje tak dýchání. Jeho nebezpečí spočívá především v tom, že je bezbarvý a bez zápachu a člověk proto jeho přítomnost v okolí nemůže poznat svými smysly. Byl příčinou mnoha smrtelných otrav v uhelných dolech nebo v domácnostech, kde se k topení používal svítiplyn.
Se sírou vytváří uhlík toxickou kapalnou sloučeninu – sirouhlík CS2, vytváří se vedením par síry přes rozžhavený uhlík.
S dusíkem tvoří uhlík kyanidový ion CN− a kyanovodík HCN patří také k mimořádně toxickým látkám. V tomto případě však můžeme detekovat čichem jeho silný zápach po hořkých mandlích.
S kovovými prvky tvoří uhlík karbidy. Nejznámější je karbid vápenatý CaC2, který při reakci s vodou uvolňuje acetylen (ethyn) a byl dříve používán ke svícení v lampách, karbidkách a na svařování. Poměrně známý je i karbid křemíku SiC neboli karborundum, který má krystalickou strukturu podobnou diamantu a vyznačuje se mimořádnou tvrdostí.
Organické sloučeniny
[editovat | editovat zdroj]

Organické sloučeniny jsou chemické látky, které obsahují alespoň jeden atom uhlíku a téměř vždy atom vodíku, převážná většina přitom má spolu vázané atomy uhlíku vazbou C-C. Každý atom uhlíku je schopen vytvářet celkem čtyři tyto tzv. jednoduché vazby, kromě toho i vazbu dvojnou C=C a vazbu trojnou C≡C. Mohou proto vznikat dlouhé řetězce a molekuly s rozvětvenou nebo cyklickou strukturou. Společně s uhlíkem se v těchto molekulách vážou i další prvky, především biogenní prvky vodík, kyslík, dusík, síra a fosfor, ale mohou to být i halogeny, křemík a mnoho dalších. Díky tomu existuje nesmírně mnoho kombinací; v dnešní době je známo více než 10 milionů organických sloučenin. Jejich výčet je pravidelně registrován v Beilsteinově databázi, která shromažďuje souhnrná data o všech známých organických sloučeninách.
Právě díky této obrovské rozmanitosti se organické látky staly základním stavebním kamenem živé hmoty. Každá buňka živého organismu obsahuje desetitisíce chemických sloučenin, které mají tu jedinou společnou vlastnost, že jejich základní skelet je tvořen atomy uhlíku v různých vazebných stavech.
Následující výčet typů organických sloučenin není zdaleka úplný a měl by pouze podat informaci o nejčastěji používaných a vyráběných typech organických látek.
Uhlovodíky jsou sloučeniny, které ve své molekule obsahují pouze atomy uhlíku a vodíku. Lze je v zásadě rozdělit na:
- alifatické uhlovodíky, jejichž molekuly mají tvar otevřeného (případně rozvětveného) řetězce a
- alicyklické uhlovodíky, jejichž molekuly mají tvar řetězce (případně rozvětveného) uzavřeného do jedné nebo více smyček, a které nespadají do aromatických
- aromatické uhlovodíky (areny), jejichž molekuly obsahují alespoň jeden uzavřený řetězec s delokalizovanými elektrony vazeb π (nejtypičtější je tzv. benzenové jádro s šesti atomy uhlíku).
První dvě skupiny pak podle vazeb mezi atomy uhlíku dělíme na:
- alkany s pouze jednoduchou vazbou C-C
- alkeny, obsahující minimálně jednu dvojnou vazbu C=C a
- alkyny, obsahující minimálně jednu trojnou vazbu C≡C
Sloučeniny, které ve své molekule obsahují C, H a O, lze zhruba rozdělit do následujících skupin:
- alkoholy, obsahující skupinu C-OH
- fenoly, které skupinu -OH mají připojenu k aromatickému jádru
- ethery, obsahující skupinu C-O-C
- organické peroxidy, obsahující skupinu C-O-O-C
- aldehydy, obsahující skupinu HC=O
- ketony, obsahující skupinu C-CO-C
- karboxylové kyseliny, obsahující skupinu -COOH
- estery, obsahující skupinu R-C-OOR
Další typy organických sloučenin, které ve své molekule obsahuji i dusík nebo síru, jsou uvedeny v heslech těchto prvků.
Principy řetězení
[editovat | editovat zdroj]Uhlík je u organických sloučeninách čtyřvazný, což odpovídá oxidačnímu číslu IV. Vazba uhlíku může být:
- jednoduchá
- dvojná vazba je vytvářena dvěma el. páry, které nejsou rovnocenné. El. vazebné, nazývané σ-elektrony, zbývající dva π-elektrony jsou pohyblivější a jsou nositeli reaktivnosti dvojné vazby.
- trojná je tvořena sdílením tří el. párů, dvěma σ- a čtyřmi π-elektrony
- rozvětvená
- nerozvětvená
- uzavřená do cyklů jednoduchých nebo složených
Volné vazby v těchto strukturách mohou být obsazeny atomy H, O, S, N nebo skupinami prvků (radikály). Sloučeniny s vazbami mezi uhlíky se nazývají nasycené (větší stálost), s dvojnou nebo trojnou vazbou jsou nenasycené.
Výskyt a využití
[editovat | editovat zdroj]Na Zemi i ve vesmíru je uhlík poměrně značně rozšířeným prvkem. V zemské kůře je jeho obsah uváděn s relativně vysokým rozptylem v rozmezí 200–800 ppm (mg/kg), obsah v mořské vodě činí 28 mg/l. Ve vesmíru připadá jeden atom uhlíku přibližně na 20 000 atomů vodíku.
Některá využití uhlíku vyžadují zlepšení tvrdosti. Proces, při němž k tomu dochází se nazývá impregnace uhlíku a provádí se buď kovy (měď, hliník, cín, stříbro, olovo, kadmium) nebo syntetickými pryskyřicemi.
Při tepelném zpracování uhlíku vznikají póry – takový proces zveme grafitace.
Grafit
[editovat | editovat zdroj]
Grafit neboli tuha je nerost neboli minerál, který se vyskytuje v mnoha lokalitách na Zemi. Jedny z největších grafitových dolů se nalézají v USA (Texas a stát New York), Mexiku, Indii a Rusku; významná byla i ložiska v jižních Čechách. Grafit je například zároveň složkou sazí, které vznikají spalováním fosilních paliv. Je přitom přítomen v částečkách natolik nepatrných rozměrů, že saze mají spíše vlastnosti amorfního uhlíku.
Grafit se průmyslově využívá především při výrobě tužek. Přitom se nejprve velmi jemně namele společně s vápnem a vylisuje se do vhodného tvaru.
Další významné uplatnění grafitu je v metalurgickém průmyslu. Vzhledem k jeho značné tepelné odolnosti se z něho vyrábějí nádoby, kokily, do kterých se odlévají roztavené kovy a jejich slitiny. Zamezí se tak kontaminaci slitiny kovem, ze kterého by se kokila musela vyrobit. Z grafitu se vyrábějí i elektrody pro elektrolytickou výrobu hliníku z taveniny směsi bauxitu a kryolitu nebo při výrobě křemíku z taveniny oxidu křemičitého.
Z grafitu se dále vyrábějí speciální typy elektrických kontaktů, např. kartáčky elektromotorů. Hlavní důvody pro toto použití uhlíku: uhlík se netaví – kontakty se nespékají a neopalují se při vysokých teplotách, nízký součinitel tření, stálý přechodový odpor.
Grafitový prach se využíval do dnes již přežitých uhlíkových mikrofonů.
Uhlík slouží také jako součást maziv (grafitová vazelína, kolomaz).
Skelný uhlík
[editovat | editovat zdroj]
Uměle vyrobenou formou uhlíku je tzv. skelný uhlík (angl. glassy carbon, tradičně zvaný též skelný grafit[pozn. 5]), který se vyznačuje vysokou hustotou, nízkou pórovitostí a značnou chemickou a mechanickou odolností. V praxi se vyrábí přesně řízeným dlouhodobým vysokoteplotním (pyrolytickým) rozkladem organických látek na povrchu normálního grafitu.
Díky mimořádným fyzikálním a chemickým vlastnostem skelného grafitu se jeho praktické využití stále rozšiřuje i přes jeho poměrně vysokou cenu.
Pro elektrochemii je důležitý fakt, že povrchy elektrod ze skelného grafitu jsou chemicky vysoce odolné a lze na nich dosáhnout vysokého kladného potenciálu, aniž by docházelo k jejich rozpuštění jako u normálních kovových elektrod. Toho lze využít jak v analytické chemii při zkoumání elektrochemických vlastností organických molekul tak pro preparativní oxidaci při výrobě některých sloučenin.
Analytická metoda GFAAS (atomová absorpční spektrometrie s bezplamennou atomizací) používá pro odpaření analyzovaného vzorku kyvetu, která se během několika sekund zahřívá až na teploty kolem 3 000 °C. Pokrytí vnitřní plochy této kyvety skelným grafitem dramaticky zvyšuje její odolnost a prodlouží její použitelnost ve srovnání s klasickou grafitovou kyvetou.
V metalurgii se pro čištění kovů na vysoké čistoty metodou zonálního tavení mohou uplatnit trubice pokryté sklelným grafitem, v nichž se tavení provádí.
Laboratorní nádobí s povrchem ze skelného grafitu dosahuje stejné nebo i lepší chemické odolnosti jako nádobí z platiny nebo její slitiny s rhodiem.
Diamant
[editovat | editovat zdroj]
Představuje jeden z nejvzácnějších a nejdražších minerálů. Vyskytuje se v různých barevných modifikacích od takřka průhledné až po černou. Protože ke vzniku diamantu je zapotřebí obrovských tlaků a vysokých teplot, jsou nalézány především tam, kde žhavé magma z velkých hloubek vystoupilo na povrch a ztuhlo. Naleziště s nejkvalitnějšími diamanty leží hlavně v Africe – JAR, Namibie, Sierra Leone, dále v Brazílii, Rusku, Kanadě a Austrálii.
Diamanty je v současné době možno vyrábět i průmyslově, i když produkty zdaleka nedosahují kvalit přírodních diamantů. Průmyslové diamanty se proto využívají především k osazování různých vrtných a řezných hlavic nástrojů, které pro svou činnost musí vykazovat mimořádnou tvrdost a odolnost.
Přírodní diamanty slouží již od pradávna především k výrobě těch nejdražších šperků. Aby se mohl diamant zasadit do zlatého nebo platinového šperku, musí být nejprve složitě a pečlivě broušen. K úspěšnému vybroušení drahého a vzácného diamantu je třeba nejen značné zkušenosti, ale i zručnosti a trpělivosti. Středisky broušení diamantů a obchodu s nimi jsou belgické Antverpy a nizozemský Rotterdam a Amsterdam.
Role v biologii
[editovat | editovat zdroj]Uhlík a jeho sloučeniny hrály zcela zásadní roli ve vzniku života tak, jak ho na Zemi známe. Těla všech organismů jsou složená právě především z organických látek, tedy látek obsahujících uhlík. Cukry, tuky, různé kyseliny včetně aminokyselin a nukleových kyselin, všechny myslitelné organické látky v tělech pozemských organismů obsahují uhlík. V lidském těle uhlík představuje 18,5 % hmotnosti,[75] v sušině těla (bez vody) je to ještě mnohem více.
Izotopy uhlíku
[editovat | editovat zdroj]V přírodě se uhlík vyskytuje ve formě izotopů 12C, 13C a 14C. Jejich vlastnosti včetně počtu protonů a neutronů v jejich jádře ukazuje tabulka.
| Izotop | Protonů | Neutronů | Atomová hmotnost | Poločas rozpadu | Výskyt v přírodě |
|---|---|---|---|---|---|
| 12C | 6 | 6 | 12 | stabilní | 98,9 % |
| 13C | 6 | 7 | 13,0033548378 | stabilní | 1,1 % |
| 14C | 6 | 8 | 14,003241989 | 5730 let | 10−10 % |
Kromě těchto přírodních izotopů existuje přes deset dalších uměle připravených izotopů. Z nich nejstabilnější je izotop 11C s poločasem rozpadu 20,3 minut.
Izotop 14C
[editovat | editovat zdroj]Tento přírodní radioaktivní izotop uhlíku vzniká ve vyšších vrstvách atmosféry. Primárním činitelem jsou zde částice kosmického záření tvořené převážně protony a jádry hélia (α-částicemi). Ty ve vysokých vrstvách atmosféry bombardují zde přítomné atomy a molekuly (především kyslíku, dusíku a vzácných plynů), čímž vzniká sekundární kosmické záření: elementární částice neutrony, positrony, miony a piony. Tyto neutrony pronikají níže do atmosféry, kde převážně ve výškách 9–15 km reagují mj. s atomy dusíku 14
7 N, čímž vzniká izotop uhlíku 14C.[76] Tuto reakci lze zapsat rovnicí
- .
Takto vzniklý uhlík zde reaguje s přítomným kyslíkem za vzniku oxidu uhličitého, který se v atmosféře promíchává a postupně se dostává až k zemskému povrchu.
Uhlík 14C (ať v atomické formě nebo ve sloučeninách) se rozpadá beta rozpadem s poločasem 5 730 let na dusík, přičemž je produkován elektron a antineutrino:
- .
Protože intenzita kosmického záření je relativně stabilní, ustavila se v zemské atmosféře rovnováha mezi produkcí uhlíku 14C a jeho radioaktivním rozpadem. Poměr všech 3 izotopů uhlíku v atmosférickém oxidu uhličitém i v jiných sloučeninách se tak dlouhodobě udržuje na konstantní hodnotě.
Radiokarbonová metoda datování
[editovat | editovat zdroj]Princip této metody zjišťování stáří materiálu vychází ze skutečnosti, že organismy v průběhu svého života průběžně přijímají a vydávají atmosférický CO2 a jeho produkty. U rostlin se tak děje především fotosyntézou, u živočichů příjmem rostlinných produktů – býložravci a následně predátoři. Poměr 14C/12C zůstává proto v průběhu života daného organizmu konstantní.
Po smrti organismu nebo odumření jakékoliv biologické tkáně se výměna uhlíku mezi organismem a prostředím zastaví. Protože v organismu další radioaktivní uhlík 14C nevzniká, klesá jeho koncentrace podle zákona radioaktivního rozpadu.
Radiokarbonová metoda datování využívá tohoto jevu a v archeologickém či jiném nálezu pozůstatku živé hmoty (zbytky tkání, kosti, popel apod.) je analyzován poměr 14C/12C. Zjištěný poměr pak poměrně přesně ukazuje na dobu zániku dané živé hmoty. Vzhledem k uvedenému poločasu rozpadu uhlíku 14C je metoda optimálně použitelná pro objekty o stáří několika set až 50 tisíc let.
Odkazy
[editovat | editovat zdroj]Poznámky
[editovat | editovat zdroj]- ↑ V roce 2009 byly objeveny další dvě teoreticky předpovězené modifikace uhlíku obdobné diamantu a lonsdaleitu.[4][5] V meteoritu Haverö třídy ureilitů byly zjištěny mikrokrystaly (řádově 10 nm) romboedrické modifikace diamantu a tzv. polytypu 21R diamantu. Obě se vyznačují tvrdostí vyšší, než má diamant, což bylo prokázáno leštěním meteoritu pastou obsahující krystaly diamantu.
- ↑ V roce 2020 byla počítačově studována nově navržená alotropní modifikace zvaná pentadiamant. Je tvořená pravidelnou krystalovou strukturou se symetrií prostorové grupy Fm3m (č. 225), kombinující atomy uhlíku s hybridizací sp2 a sp3, a významně překonává tvrdost diamantu: Její modul pružnosti v tahu je 1691 GPa (diamant podle orientace pouze 1050–1210 GPa) a modul pružnosti ve smyku 1113 GPa (diamant pouze cca 480 GPa). Je předpovězeno polovodičové chování.[6][7]
- ↑ Název lonsdaleit se používá jak pro alotropní modifikaci s pravidelnou strukturou šesterečného diamantu (popsanou Bundym a Kasperem v r. 1967), tak i pro minerál odpovídající původnímu vzorku, na základě kterého byl popsán, který byl však později identifikován jako polymorf více uhlíkových struktur, zejména diamantu, grafitu a chaoitu s přechodovými diafitovými strukturami.[13][14][15][16]
- ↑ Studie ukázala, že je možné vytvořit 346 516 metastabilních struktur odlišné geometrie,[55] a určila jejich vazebné energie.
- ↑ Zažitý název "skelný grafit" je zavádějící, nejedná se o formu grafitu ale o obecnější formu uhlíku, neboť jeho struktura není typicky grafitová, ale spíše fullerenová.[43]
Reference
[editovat | editovat zdroj]- ↑ a b Carbon. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ http://www.beilstein-journals.org/bjoc/home/home.htm
- ↑ http://www.stn-international.com/index.php?id=123
- ↑ FERROIR, Tristan; DUBROVINSKY, Leonid; EL GORESY, Ahmed; SIMIONOVICI, Alexandre; NAKAMURA, Tomoki; GILLET, Philippe. Carbon polymorphism in shocked meteorites: Evidence for new natural ultrahard phases. S. 150–154. Earth and Planetary Science Letters [online]. 2010-02-15 [cit. 2010-02-04]. Svazek 290, čís. 1–2, s. 150–154. Dostupné online. ISSN 0012-821X. DOI 10.1016/j.epsl.2009.12.015. (anglicky)
- ↑ Popularizační zpráva k předchozí referenci
- ↑ FUJII, Yasumaru; MARUYAMA, Mina; CUONG, Nguyen Thanh; OKADA, Susumu. Pentadiamond: A Hard Carbon Allotrope of a Pentagonal Network of sp2 and sp3 C Atoms. Physical Review Letters [online]. 30. červen 2020 [cit. 2020-07-01]. Svazek 125, čís. 1: 016001. Dostupné online. ISSN 1079-7114. DOI 10.1103/PhysRevLett.125.016001. (anglicky)
- ↑ University of Tsukuba. Researchers building a harder diamond, called pentadiamonds. Phys.Org [online]. 2020-07-01 [cit. 2020-07-01]. Dostupné online. (anglicky)
- ↑ NÉMETH, Péter; MCCOLL, Kit; SMITH, Rachael L.; MURRI, Mara; GARVIE, Laurence A. J.; ALVARO, Matteo; PÉCZ, Béla. Diamond-Graphene Composite Nanostructures. S. 3611–3619. Nano Letters [online]. 2020-05-13. Roč. 20, čís. 5, s. 3611–3619. ISSN 1530-6984. DOI 10.1021/acs.nanolett.0c00556. (anglicky)
- ↑ Materials science: Diaphite domains. S. 129–129. Nature [online]. 2009-03. Roč. 458, čís. 7235, s. 129–129. DOI 10.1038/458129d. (anglicky)
- ↑ OHNISHI, Hiromasa; NASU, Keiichiro. Photoinduced domain-type collective structural changes with interlayer σ -bonds in the visible region of graphite. S. 054111. Physical Review B [online]. 2009-02-24. Roč. 79, čís. 5, s. 054111. DOI 10.1103/PhysRevB.79.054111. (anglicky)
- ↑ VRTIŠKA, Ondřej. Tvrdší než diamant. S. 601. Vesmír [online]. 2022-10-03 [cit. 2022-10-07]. Roč. 101, čís. 2022/10, s. 601. Dostupné online. ISSN 1214-4029.
- ↑ JARMAN, Sam. Rare form of diamond exists independently in meteorites. PhysicsWorld [online]. IOP Publishing, 2022-10-04 [cit. 2022-10-07]. Dostupné online. (anglicky)
- ↑ Lonsdaleite. Mindat Dostupné online (anglicky)
- ↑ NÉMETH, Péter; MCCOLL, Kit; GARVIE, Laurence A. J.; SALZMANN, Christoph G.; MURRI, Mara; MCMILLAN, Paul F. Complex nanostructures in diamond. S. 1126–1131. Nature Materials [online]. 2020-11. Roč. 19, čís. 11, s. 1126–1131. preprint. DOI 10.1038/s41563-020-0759-8. (anglicky)
- ↑ NÉMETH, Péter; LANCASTER, Hector J.; SALZMANN, Christoph G.; MCCOLL, Kit; FOGARASSY, Zsolt; GARVIE, Laurence A. J.; ILLÉS, Levente. Shock-formed carbon materials with intergrown sp 3 - and sp 2 -bonded nanostructured units. Proceedings of the National Academy of Sciences [online]. 2022-07-26. Roč. 119, čís. 30: e2203672119. DOI 10.1073/pnas.2203672119. (anglicky)
- ↑ HOUSER, Pavel. Při dopadu asteroidu vznikl lonsdaleit, zvláštní diamant kombinovaný s grafenem. SCIENCEmag.cz [online]. 2022-09-19 [cit. 2022-09-22]. Dostupné online.
- ↑ ŠÁRA, Filip. Výzkumníci z ČVUT a Německa objevili nový materiál z uhlíku. Může nahradit polovodiče. Novinky.cz [online]. 2024-08-21 [cit. 2024-08-21]. Dostupné online.
- ↑ FCC-uhlík: Nový kvazivalentní materiál. Katedra fyziky kondenzovaných látek: Novinky [online]. Univerzita Karlova, Matematicko-fyzikální fakulta, Katedra fyziky kondenzovaných látek, 2024-07-20 [cit. 2024-08-21]. Dostupné online.
- ↑ KONYASHIN, Igor; MUYDINOV, Ruslan; CAMMARATA, Antonio; BONDAREV, Andrey; RUSU, Marin; KOLIOGIORGOS, Athanasios; POLCAR, Tomáš. Face-centered cubic carbon as a fourth basic carbon allotrope with properties of intrinsic semiconductors and ultra-wide bandgap. Communications Materials [online]. 2024-07-02 [cit. 2024-08-21]. Roč. 5: 115. Dostupné online. ISSN 2662-4443. DOI 10.1038/s43246-024-00547-8. (anglicky)
- ↑ NGUYEN-CONG, Kien; WILLMAN, Jonathan T.; GONZALEZ, Joseph M.; WILLIAMS, Ashley S.; BELONOSHKO, Anatoly B.; MOORE, Stan G.; THOMPSON, Aidan P. Extreme Metastability of Diamond and its Transformation to the BC8 Post-Diamond Phase of Carbon. S. 1152–1160. The Journal of Physical Chemistry Letters [online]. ACS Publications, 2024-02-01 [cit. 2024-03-22]. Roč. 15, čís. 4, s. 1152–1160. Dostupné online. DOI 10.1021/acs.jpclett.3c03044. (anglicky)
- ↑ STARK, Anne M. Supercomputer simulations of super-diamond suggest a path to its creation. Phys.Org [online]. [cit. 2024-03-22]. Dostupné online. (anglicky)
- ↑ a b c KUDRYAVTSEV, Yu. P.; HEIMANN, R. B.; EVSYUKOV, S. E. Carbynes: Advances in the field of linear carbon chain compounds. S. 5557–5571. Journal of Materials Science [online]. Kluwer Academic Publishers, listopad 1996. Svazek 31, čís. 21, s. 5557–5571. Dostupné online. Dostupné také na: [1]. ISSN 1573-4803. DOI 10.1007/BF01160799. (anglicky)
- ↑ a b LI, Shandong; JI, Guangbin; HUANG, Zhigao; ZHANG, Fengming; DU, Youwei. Synthesis of chaoite-like macrotubes at low temperature and ambient pressure. S. 2946–2950. Carbon [online]. Elsevier Ltd., 1. říjen 2007. Svazek 45, čís. 15, s. 2946–2950. Dostupné online. ISSN 0008-6223. DOI 10.1016/j.carbon.2007.09.048. (anglicky)
- ↑ CHEN, Shanshan; WU, Qingzhi; MISHRA, Columbia; KANG, Junyong; ZHANG, Hengji; CHO, Kyeongjae; CAI, Weiwei. Thermal conductivity of isotopically modified graphene. S. 203–207. Nature Materials [online]. 2012-03. Roč. 11, čís. 3, s. 203–207. Dostupné online. DOI 10.1038/nmat3207. (anglicky)
- ↑ University of Manchester. Graphene and 2-D materials could move electronics beyond 'Moore's law'. Phys.Org [online]. 2020-06-03 [cit. 2020-06-23]. Dostupné online. (anglicky)
- ↑ DUMÉ, Isabelle. ‘Magic-angle’ graphene doubles up. Physics World [online]. IOP Publishing, 2020-06-22 [cit. 2020-06-25]. Dostupné online. (anglicky)
- ↑ Princeton University. Cascade sets the stage for superconductivity in magic-angle twisted bilayer graphene. Phys.Org [online]. 2020-06-11 [cit. 2020-06-23]. Dostupné online. (anglicky)
- ↑ Weizmann Institute of Science. A new symmetry-broken parent state discovered in twisted bilayer graphene. Phys.Org [online]. 2020-06-22 [cit. 2020-06-23]. Dostupné online. (anglicky)
- ↑ MALKO, Daniel; NEISS, Christian; VIÑES, Francesc, GÖRLING Andreas. Competition for Graphene: Graphynes with Direction-Dependent Dirac Cones. Physical Review Letters. 24. únor 2012, svazek 108, čís. 8, s. e086804: 1–4. Dostupné online [abstrakt]. DOI 10.1103/PhysRevLett.108.086804. (anglicky)
- ↑ SCHIRBER, Michael. Focus: Graphyne May Be Better than Graphene. Physics [online]. 24. únor 2012. Svazek 5, čís. 24. Popularizační článek k předchozí referenci. Dostupné online. DOI 10.1103/Physics.5.24. (anglicky)
- ↑ HU, Yiming; WU, Chenyu; PAN, Qingyan, et al. Synthesis of γ-graphyne using dynamic covalent chemistry. Nature Synthesis [online]. 2022-05-09 [cit. 2022-05-23]. Dostupné online. ISSN 2731-0582. DOI 10.1038/s44160-022-00068-7. (anglicky)
- ↑ LEYTHAM-POWELL, Cay. Long-hypothesized 'next generation wonder material' created for first time. Phys.Org [online]. 2022-05-21 [cit. 2022-05-23]. Dostupné online. (anglicky)
- ↑ HOUSER, Pavel. Anodu budoucích baterií by mohl tvořit ne grafit ani grafen, ale grafdiyn. SCIENCEmag.cz [online]. Nitemedia s.r.o., 2020-06-19 [cit. 2020-06-23]. Dostupné online.
- ↑ Wiley. Two-dimensional carbon networks: Graphdiyne as a functional lithium-ion storage material. Phys.Org [online]. 2020-06-18 [cit. 2020-06-23]. Dostupné online. (anglicky)
- ↑ a b Spitzer finds solid buckyballs in space. PhysOrg, 22. února 2012 (anglicky)
- ↑ MATYÁŠ, Miloš. Fullereny a fullerity. Pokroky matematiky, fyziky a astronomie. 1992, roč. 37, čís. 5, s. 289. Dostupné online [PDF].
- ↑ Fullerit v mineralogické databázi Mindat.org
- ↑ MEIRZADEH, Elena; EVANS, Austin M.; REZAEE, Mehdi; MILICH, Milena; DIONNE, Connor J.; DARLINGTON, Thomas P.; BAO, Si Tong. A few-layer covalent network of fullerenes. S. 71–76. Nature [online]. Springer Nature Limited, 2023-01-05 [cit. 2023-01-16]. Roč. 613, čís. 7942, s. 71–76. ISSN 1476-4687. DOI 10.1038/s41586-022-05401-w. (anglicky)
- ↑ NEFF, Ellen. Newly discovered form of carbon is graphene's 'superatomic' cousin. Phys.Org [online]. 2023-01-05 [cit. 2023-01-16]. Dostupné online. (anglicky)
- ↑ HOUSER, Pavel. Další uhlíkový materiál: Syntetizovali grafulleren, superatomární grafen. SCIENCEmag.cz [online]. 2023-01-15 [cit. 2023-01-16]. Dostupné online.
- ↑ Moskevský fyzikálně-technický institut: How fullerite becomes harder than diamond. Phys.org, 21. březen 2017. Dostupné online (anglicky)
- ↑ PERKINS Ceri: New form of carbon is so hard it can indent diamond. PhysicsWorld, 16. srpen 2012 (anglicky)
- ↑ a b Fullerene-related structure of commercial glassy carbons, P.J.F. Harris, 2003.
- ↑ MIHULKA, Stanislav. Nové ultratvrdé diamantové sklo vyrobili z rozmačkaných fullerenů. OSEL.cz [online]. 2021-11-26 [cit. 2021-11-29]. Dostupné online. ISSN 1214-6307.
- ↑ SHANG, Yuchen; LIU, Zhaodong; DONG, Jiajun, et al. Ultrahard bulk amorphous carbon from collapsed fullerene. S. 599–604. Nature [online]. 2021-11-24 [cit. 2021-11-29]. Roč. 599, čís. 7886, s. 599–604. Dostupné online. ISSN 1476-4687. DOI 10.1038/s41586-021-03882-9. PMID 34819685. (anglicky)
- ↑ Meng Hu; Julong He; Zhisheng Zhao; STROBEL, Timothy A.; Wentao Hu; Dongli Yu; Hao Sun, Lingyu Liu; Zihe Li; Mengdong Ma; Yoshio Kono; Jinfu Shu; Ho-Kwang Mao; Yingwei Fei; Guoyin Shen; Yanbin Wang; JUHL, Stephen J.; Jian Yu Huang; Zhongyuan Liu; Bo Xu; Yongjun Tian. Compressed glassy carbon: An ultrastrong and elastic interpenetrating graphene network. S. 1–7. Science Advances [online]. American Association for the Advancement of Science, 9. červen 2017. Roč. 3, čís. 6: e1603213, s. 1–7. Dostupné online. ISSN 2375-2548. DOI 10.1126/sciadv.1603213. (anglicky)
- ↑ MIHULKA, Stanislav. Nová forma uhlíku je tvrdá jako kámen a elastická jako guma. OSEL.cz [online]. 12. červen 2017. Dostupné online.
- ↑ RODE, A. V., Gamaly, E. G.; Luther-Davies, B. Formation of cluster-assembled carbon nano-foam by high-repetition-rate laser ablation. Applied Physics A: Materials Science & Processing. 2000, svazek 70, čís. 2, s. 135–144. DOI 10.1007/s003390050025. (anglicky)
- ↑ RODE, A. V., et al.. Electronic and magnetic properties of carbon nanofoam produced by high-repetition-rate laser ablation. Applied Surface Science. 2002, svazek 197–198, s. 644–649. DOI 10.1016/S0169-4332(02)00433-6. (anglicky)
- ↑ FELIX, Levi C.; WOELLNER, Cristiano F.; GALVAO, Douglas S. Mechanical and energy-absorption properties of schwarzites. S. 670–680. Carbon [online]. Elsevier Ltd., 2020-02 [cit. 2023-02-03]. Svazek 157, s. 670–680. Dostupné online. ISSN 0008-6223. DOI 10.1016/j.carbon.2019.10.066. (anglicky)
- ↑ SANDERS, Robert. Long-sought carbon structure joins graphene, fullerene family. Berkeley News [online]. 2018-08-13 [cit. 2023-02-03]. Dostupné online. (anglicky)
- ↑ BRAUN, Efrem; LEE, Yongjin; MOOSAVI, Seyed Mohamad; BARTHEL, Senja; MERCADO, Rocio; BABURIN, Igor A.; PROSERPIO, Davide M. Generating carbon schwarzites via zeolite-templating. Proceedings of the National Academy of Sciences [online]. 2018-08-28. Roč. 115, čís. 35. DOI 10.1073/pnas.1805062115. (anglicky)
- ↑ University of California - Berkeley. Schwarzites: Long-sought carbon structure joins graphene, fullerene family. Phys.Org [online]. 2018-08-13 [cit. 2023-02-03]. Dostupné online. (anglicky)
- ↑ PAN, Fei; NI, Kun; XU, Tao; CHEN, Huaican; WANG, Yusong; GONG, Ke; LIU, Cai. Long-range ordered porous carbons produced from C60. S. 95–101. Nature [online]. Springer Nature Limited, 2023-02-02 [cit. 2023-02-03]. Roč. 614, čís. 7946, s. 95–101. Dostupné online. ISSN 1476-4687. DOI 10.1038/s41586-022-05532-0. (anglicky)
- ↑ PAN, Fei; NI, Kun; XU, Tao; CHEN, Huaican; WANG, Yusong; GONG, Ke; LIU, Cai. Long-range ordered porous carbons produced from C60. Supplementary information. Kapitola Appendix, s. 95–101. Nature [online]. 2023-02-02 [cit. 2023-02-03]. Roč. 614, čís. 7946, s. 95–101. Dostupné online. DOI 10.1038/s41586-022-05532-0. (anglicky)
- ↑ LI, Quan; MA, Yanming; OGANOV, Artem R.; WANG, Hongbo; WANG, Hui; XU, Ying; CUI, Tian. Superhard Monoclinic Polymorph of Carbon. S. 175506. Physical Review Letters [online]. 2009-04-29. Roč. 102, čís. 17, s. 175506. DOI 10.1103/PhysRevLett.102.175506. PMID 19518796. (anglicky)
- ↑ WANG, Yuejian; PANZIK, Joseph E.; KIEFER, Boris; LEE, Kanani K. M. Crystal structure of graphite under room-temperature compression and decompression. S. 520. Scientific Reports [online]. 2012-07-19 [cit. 2023-02-03]. Roč. 2, čís. 1, s. 520. Dostupné online. ISSN 2045-2322. DOI 10.1038/srep00520. PMID 22816043. (anglicky)
- ↑ a b LEE, Kanani K.M. Diamond in the rough: Half-century puzzle solved. Phys.Org [online]. 2012-07-20 [cit. 2023-02-03]. Dostupné online. (anglicky)
- ↑ NARAYAN, Jagdish; BHAUMIK, Anagh. Novel Phase of Carbon, Ferromagnetism and Conversion into Diamond. Journal of Applied Physics [online]. 2015. Před vydáním. ISSN 1089-7550. DOI 10.1063/1.4936595. (anglicky)
- ↑ NARAYAN, Jagdish; BHAUMIK, Anagh. Direct conversion of amorphous carbon into diamond at ambient pressures and temperatures in air. Kapitola Research Update. APL Materials [online]. 7. říjen 2015 [cit. 02-12-2015]. Svazek 3, čís. 10:100702. Dostupné v archivu pořízeném dne 03-12-2015. PDF [2]. ISSN 2166-532X. DOI 10.1063/1.4932622. (anglicky)
- ↑ Shipman. Researchers Find New Phase of Carbon, Make Diamond at Room Temperature. NC State News [online]. 30. listopad 2015. Popularizační článek k předchozím referencím. Dostupné online. (anglicky)
- ↑ MIHULKA, Stanislav. Vědci objevili novou a velice slibnou formu pevného uhlíku. OSEL.cz [online]. 1. prosinec 2015. Popularizační článek k předchozím referencím. Dostupné online.
- ↑ HOUSER, Pavel. Uhlíkový kruh z 18 atomů. SCIENCEmag.cz [online]. Nitemedia s.r.o., 19. srpen 2019. Dostupné online.
- ↑ MIHULKA, Stanislav. Pán uhlíkových prstenů: Materiáloví vědci dosáhli legendárního průlomu. OSEL.cz [online]. 18. srpen 2019. Dostupné online. ISSN 1214-6307.
- ↑ LIU, Mingjie; ARTYUKHOV, Vasilii I.; LEE, Hoonkyung, XU, Fangbo; YAKOBSON, Boris I. Carbyne from First Principles: Chain of C Atoms, a Nanorod or a Nanorope?. ACS Nano [online]. 5. říjen 2013. Online před tiskem. Dostupné online. PDF [3]. ISSN 1936-086X. DOI 10.1021/nn404177r. (anglicky)
- ↑ OWANO, Nancy. Carbyne is stronger than any known material. PhysOrg, 20. srpen 2013. Dostupné online (anglicky)
- ↑ Carbon's new champion: Theorists calculate atom-thick carbyne chains may be strongest material ever. PhysOrg, 10. říjen 2013. Dostupné online (anglicky)
- ↑ PAZDERA, Josef: Nejpevnější materiál na světě aneb už v Sovětském svazu. OSEL.cz, 12. říjen 2013.Dostupné online.
- ↑ KASATOCHKIN, V.I; KORSHAK, V.V; KUDRYAVTSEV, Yu.P; SLADKOV, A.M; STERENBERG, I.E. On crystalline structure of carbyne. S. 70–72. Carbon [online]. Elsevier Ltd., 1973-02. Roč. 11, čís. 1, s. 70–72. Dostupné online. ISSN 0008-6223. DOI 10.1016/0008-6223(73)90012-2. (anglicky)
- ↑ Harry Kroto: "Carbyne and other myths about carbon", RSC Chemistry World, listopad 2010
- ↑ BANKHAMER, Alfred. Carbin - Der eindimensionale Superstoff. Austria Innovativ [online]. Verlag Holzhausen, duben 2016 [cit. 2018-05-24]. Čís. 2/2016. Dostupné v archivu pořízeném dne 2018-05-24. (německy)
- ↑ LUHYNA, Nataliia; RAFIQUE, Rafaila; IQBAL, Sadia Sagar; KHALIQ, Jibran; SAHARUDIN, Mohd Shahneel; WEI, Jiacheng; QADEER, Quratulane. Novel Carbyne Filled Carbon Nanotube – Polymer Nanocomposites. NanoWorld Journal [online]. 2020. Roč. 06, čís. 02. Dostupné online. Dostupné také na: [4]. ISSN 2379-1101. DOI 10.17756/nwj.2020-078. (anglicky)
- ↑ KORSHAK, Vasilii V.; KUDRYAVTSEV, Yuri P.; KORSHAK, Yuri V.; EVSYUKOV, Sergey E.; KHVOSTOV, Valerii V.; BABAEV, Vladimir G.; GUSEVA, Malvina B. Formation of β‐carbyne by dehydrohalogenation. S. 119–194. Die Makromolekulare Chemie/Macromolecular Rapid Communictions [online]. John Wiley & Sons, Inc., březen 1988. Svazek 9, čís. 3, s. 119–194. Dostupné online. DOI 10.1002/marc.1988.030090304. (anglicky)
- ↑ XUE, Kuan-Hong; TAO, Fei-Fei; SHEN, Wei; HE, Chun-Jian; CHEN, Qiao-Ling; WU, Li-Jun; ZHU, Yi-Mei. Linear carbon allotrope – carbon atom wires prepared by pyrolysis of starch. S. 477–480. Chemical Physics Letters [online]. Elsevier B.V., 2004-02. Roč. 385, čís. 5–6, s. 477–480. ISSN 0009-2614. DOI 10.1016/j.cplett.2004.01.007. (anglicky)
- ↑ DARLING, David. The Encyclopedia of Science; biological abundance of elements [online]. Dostupné online.
- ↑ WAGNER, Vladimír. Jaderná fyzika a kulturní dědictví [online]. Osel,s.r.o., 2008-03-15 [cit. 2014-07-15]. Kapitola Určování stáří. Dostupné online.
Literatura
[editovat | editovat zdroj]- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood – A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj]Obrázky, zvuky či videa k tématu uhlík na Wikimedia Commons
Téma Uhlík ve Wikicitátech
Slovníkové heslo uhlík ve Wikislovníku
- (česky) Chemický vzdělávací portál
- (anglicky) Carbon on Britannica
- (anglicky) alotropní modifikace uhlíku v Topological Materials Database
- Carbon – Super Stuff. Animation with sound and interactive 3D-models.

