Karboksilacija
Karboksilacija je hemijska reakcija u kojoj se grupa karboksilnih kiselina proizvodi tretiranjem supstrata ugljik-dioksidom.[1] Suprotna reakcija je dekarboksilacija. U hemiji, termin karbonizacija se ponekad koristi kao sinonim za karboksilaciju, posebno kada se primjenjuje na reakciju karbanionskih reagensa sa CO2. Općenito, karbonizacija obično opisuje proizvodnju karbonata.[2]
Organska hemija
[uredi | uredi izvor]Karboksilacija je standardna konverzija u organskoj hemiji.[3] Konkretno, karbonizacija (tj. karboksilacija) Grignardovog reagensa i organolitijskih spojeva jest klasični način pretvaranja organskih halogenida u karboksilne kiseline.[4]
Natrij-salicilat, prekursor aspirina, komercijalno se priprema tretiranjem natrij-fenolata (natrijeve soli fenola) sa ugljik-dioksidom, pod visokim pritiskom (100 atm) i visokom temperaturom (390 K) – metod poznat kao Kolbe-Schmittova reakcija. Zakiseljavanje rezultirajuće soli salicilata daje salicilnu kiselinu.
Mnogi detaljni postupci su opisani u časopisu Organic Syntheses.[5][6][7]
Katalizatori karboksilacije uključuju N-heterociklične karbene [8] i katalizatore na bazi srebra.[9]
Karboksilacija u biohemiji
[uredi | uredi izvor]Život zasnovan na ugljiku potiče od karboksilacije koja spaja atmosferski ugljik-dioksid sa šećerom. Proces se obično katalizira enzimom RuBisCO. Ribuloza-1,5-bisfosfat karboksilaza/oksigenaza, enzim koji katalizira ovu karboksilaciju, vjerovatno je najzastupljeniji protein na Zemlji.[10][11][12]
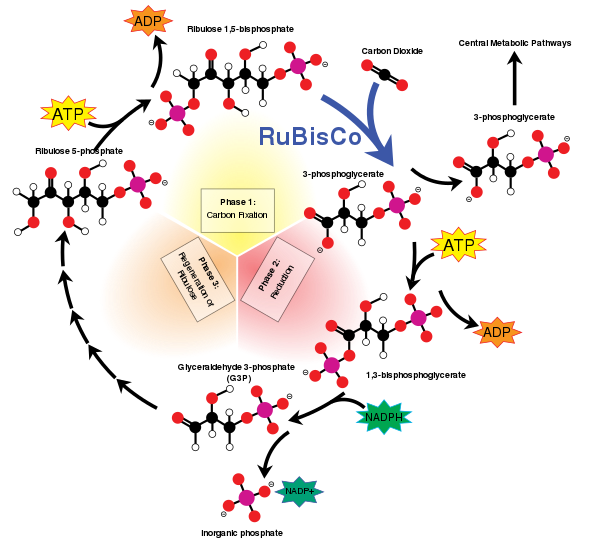

Mnoge karboksilaze, uključujući acetil-CoA karboksilazu, metilkrotonil-CoA karboksilazu, propionil-CoA karboksilazu i piruvat karboksilazu zahtijevaju biotin kao kofaktor. Ovi enzimi su uključeni u različite biogene puteve.[13] U EC shemi, takve karboksilaze su klasifikovane pod EC 6.3.4, "Ostale ugljiko-dušične ligaze".
Drugi primjer je posttranslacijska modifikacija ostataka glutamata u γ-karboksiglutamat u proteinima. Javlja se prvenstveno u proteinima uključenim u kaskadu zgrušavanja krvi, posebno faktorima II, VII, IX i X, proteinu C i proteinu S, kao i u nekim koštanim proteinima. Ova modifikacija je potrebna da bi ovi proteini funkcionisali. Karboksilacija se dešava u jetri i izvodi je γ-glutamil karboksilaza (GGCX).[14] GGCX zahtijeva vitamin K kao kofaktor i izvodi reakciju na procesivan način.[15] Gama-karboksiglutamat vezuje kalcij koji je neophodan za njegovu aktivnost.[16] Naprimjer, u protrombinu, vezivanje kalcija omogućava proteinu da se poveže sa plazmamembranom u trombocitima, dovodeći ga u blisku blizinu proteinima koji, nakon povrede, cijepaju protrombin u aktivni trombin.[17]
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ "Carboxylation: The introduction of a carboxyl group into a molecule or compound to form a carboxylic acid or a carboxylate; an instance of this."Oxford English Dictionary. Oxford University Press. 2018.
- ^ "Carbonation: Impregnation or treatment with carbon dioxide; conversion into a carbonate."Oxford English Dictionary. Oxford University Press. 2018.
- ^ Braunstein, Pierre; Matt, Dominique; Nobel, Dominique (august 1988). "Reactions of Carbon Dioxide with Carbon-Carbon Bond Formation Catalyzed by Transition-Metal Complexes". Chemical Reviews. 88 (5): 747–764. doi:10.1021/cr00087a003.
- ^ A. M. Appel; et al. (2013). "Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO2 Fixation". Chem. Rev. 113 (8): 6621–6658. doi:10.1021/cr300463y. PMC 3895110. PMID 23767781.
- ^ Akira Yanagisawa; Katsutaka Yasue; Hisashi Yamamoto (1997). "Regio- and Stereoselective Carboxylation of Allylic Barium Reagents: (E)-4,8-Dimethyl-3,7-Nonadienoic Acid". Organic Syntheses. 74: 178. doi:10.15227/orgsyn.074.0178.
- ^ H. Koch; W. Haaf (1964). "1-Adamantanecarboxylic Acid". Organic Syntheses. 44: 1. doi:10.15227/orgsyn.044.0001.
- ^ W. Haaf (1966). "1-Methylcyclohexanecarboxylic Acid". Organic Syntheses. 46: 72. doi:10.15227/orgsyn.046.0072.
- ^ Zhang Liang (2013). "N-Heterocyclic carbene (NHC)–copper-catalysed transformations of carbon dioxide". Chemical Science. 4 (9): 3395. doi:10.1039/C3SC51070K.
- ^ K. Sekine; T. Yamada (2016). "Silver-catalyzed carboxylation". Chem. Soc. Rev. 45 (16): 4524–4532. doi:10.1039/C5CS00895F. PMID 26888406.
- ^ Dhingra A, Portis AR, Daniell H (april 2004). "Enhanced translation of a chloroplast-expressed RbcS gene restores small subunit levels and photosynthesis in nuclear RbcS antisense plants". Proc. Natl. Acad. Sci. U.S.A. 101 (16): 6315–20. Bibcode:2004PNAS..101.6315D. doi:10.1073/pnas.0400981101. PMC 395966. PMID 15067115.
(Rubisco) is the most prevalent enzyme on this planet, accounting for 30–50% of total soluble protein in the chloroplast;
- ^ Feller U, Anders I, Mae T (2008). "Rubiscolytics: fate of Rubisco after its enzymatic function in a cell is terminated" (PDF). J. Exp. Bot. 59 (7): 1615–24. doi:10.1093/jxb/erm242. PMID 17975207.
- ^ Raven, John A. (april 2013). "Rubisco: still the most abundant protein of Earth?". New Phytologist. 198 (1): 1–3. doi:10.1111/nph.12197. PMID 23432200.
- ^ "Biotin – Fact Sheet for Health Professionals". Office of Dietary Supplements, US National Institutes of Health. 8. 12. 2017. Pristupljeno 25. 2. 2018.
- ^ OMIM - gamma-glutamyl carboxylase, contributed by McKusick VA, last updated October 2004 [1]
- ^ Morris DP, Stevens RD, Wright DJ, Stafford DW (1995). "Processive post-translational modification. Vitamin K-dependent carboxylation of a peptide substrate". J. Biol. Chem. 270 (51): 30491–8. doi:10.1074/jbc.270.51.30491. PMID 8530480.
- ^ Hauschka PV, Lian JB, Gallop PM (1975). "Direct identification of the calcium-binding amino acid, gamma-carboxyglutamate, in mineralized tissue". Proc. Natl. Acad. Sci. U.S.A. 72 (10): 3925–9. Bibcode:1975PNAS...72.3925H. doi:10.1073/pnas.72.10.3925. PMC 433109. PMID 1060074.
- ^ Berg JM, Tymoczko JL, Stryer L. Biochemistry, 5th ed. New York: W. H. Freeman and Company, 2002.
