Chlorid vanaditý
| Chlorid vanaditý | |
|---|---|
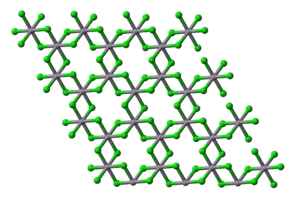 Krystalová struktura VCl3 | |
 Vrstvy v krystalu VCl3 | |
| Obecné | |
| Systematický název | Chlorid vanaditý |
| Anglický název | Vanadium(III) chloride |
| Německý název | Vanadium(III)-chlorid |
| Sumární vzorec | VCl3 |
| Vzhled | fialové krystaly |
| Identifikace | |
| Registrační číslo CAS | 7718-98-1 |
| PubChem | 62647 |
| SMILES | [V+3].[Cl-].[Cl-].[Cl-] |
| InChI | InChI=1S/3ClH.V/h3*1H;/q;;;+3/p-3 |
| Vlastnosti | |
| Molární hmotnost | 157,30 g/mol |
| Teplota tání | >300 °C (rozklad) |
| Hustota | 3,0 g/cm3 |
| Rozpustnost ve vodě | rozpustný |
Některá data mohou pocházet z datové položky. | |
Chlorid vanaditý, VCl3, je fialová pevná látka.[1] Slouží jako prekurzor pro přípravu jiných sloučenin vanadu.
Struktura
[editovat | editovat zdroj]VCl3 má strukturu jodidu bismutitého, chloridové anionty jsou uspořádány do nejtěsnějšího hexagonálního uspořádání a vanadité ionty obsazují oktaedrické mezery. Stejnou strukturu mají i bromid a jodid vanaditý, ale VF3 se strukturou blíží spíše oxidu rheniovému. VCl3 je paramagnetický, má dva nepárové elektrony.
Příprava a reakce
[editovat | editovat zdroj]Chlorid vanaditý se připravuje zahříváním VCl4 na teplotu 160-170 °C v proudu inertního plynu, který odnáší vznikající chlor.[2][3]
- 2 VCl4 → 2 VCl3 + Cl2
Zahříváním dochází k disproporcionaci:[2][3]
- 2 VCl3 → VCl4 + VCl2
Zahříváním ve vodíkové atmosféře na teplotu 675 °C dochází k redukci:[4]
- 2 VCl3 + H2 → 2 VCl2 + 2 HCl
Refluxem v THF a následnou krystalizací lze získat oktaedrický solvát VCl3(THF)3.[5]

Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Vanadium(III)_chloride na anglické Wikipedii.
- ↑ GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. OCLC 320245801 S. 1224.
- ↑ a b HOUSECROFT, Catherine E. Anorganická chemie. Vyd. 1. vyd. Praha: Vysoká škola chemicko-technologická v Praze xxx, 1119 s. s. Dostupné online. ISBN 978-80-7080-872-6, ISBN 80-7080-872-1. OCLC 894846634 S. 714–715.
- ↑ a b YOUNG, Ralph C.; SMITH, Maynard E.; MOELLER, Therald. Vanadium(III) Chloride. Příprava vydání John C. Bailar. Hoboken, NJ, USA: John Wiley & Sons, Inc. Dostupné online. ISBN 978-0-470-13235-7, ISBN 978-0-470-13163-3. DOI 10.1002/9780470132357.ch43. S. 128–130. DOI: 10.1002/9780470132357.ch43.
- ↑ YOUNG, Ralph C.; SMITH, Maynard E.; MOELLER, Therald. Vanadium(II) Chloride. Příprava vydání John C. Bailar. Hoboken, NJ, USA: John Wiley & Sons, Inc. Dostupné online. ISBN 978-0-470-13235-7, ISBN 978-0-470-13163-3. DOI 10.1002/9780470132357.ch42. S. 126–127. DOI: 10.1002/9780470132357.ch42.
- ↑ MANXZER, L. E.; DEATON, Joe; SHARP, Paul. 31. Tetragtdrfuran Complexes of Selected Early Transition Metals.. Příprava vydání John P. Fackler. Hoboken, NJ, USA: John Wiley & Sons, Inc. Dostupné online. ISBN 978-0-470-13252-4, ISBN 978-0-471-86520-9. DOI 10.1002/9780470132524.ch31. S. 135–140. DOI: 10.1002/9780470132524.ch31.
Externí odkazy
[editovat | editovat zdroj]Obrázky, zvuky či videa k tématu Chlorid vanaditý na Wikimedia Commons